Page 59 - E-Modul_Asam Basa_Nur Fadillah_Unimed
P. 59
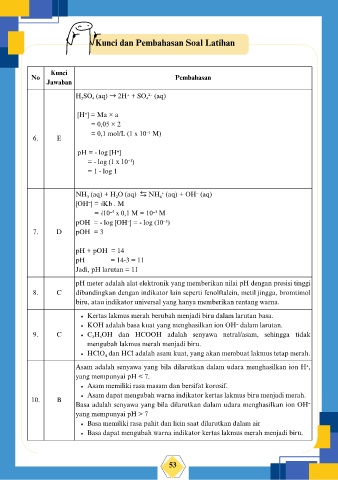
Kunci dan Pembahasan Soal Latihan
Kunci
No Pembahasan
Jawaban
H₂SO₄ (aq) → 2H⁺ + SO₄²⁻ (aq)
[H⁺] = Ma × a
= 0,05 × 2
= 0,1 mol/L (1 x 10⁻¹ M)
6. E
pH = - log [H⁺]
= - log (1 x 10⁻¹)
= 1 - log 1
NH₃ (aq) + H₂O (aq) ⇆ NH₄⁺ (aq) + OH⁻ (aq)
[OH⁻] = √Kb . M
= √10⁻⁵ x 0,1 M = 10⁻³ M
pOH = - log [OH⁻] = - log (10⁻³)
7. D pOH = 3
pH + pOH = 14
pH = 14-3 = 11
Jadi, pH larutan = 11
pH meter adalah alat elektronik yang memberikan nilai pH dengan presisi tinggi
8. C dibandingkan dengan indikator lain seperti fenolftalein, metil jingga, bromtimol
biru, atau indikator universal yang hanya memberikan rentang warna.
Kertas lakmus merah berubah menjadi biru dalam larutan basa.
KOH adalah basa kuat yang menghasilkan ion OH⁻ dalam larutan.
9. C C₂H₅OH dan HCOOH adalah senyawa netral/asam, sehingga tidak
mengubah lakmus merah menjadi biru.
HClO₄ dan HCl adalah asam kuat, yang akan membuat lakmus tetap merah.
Asam adalah senyawa yang bila dilarutkan dalam udara menghasilkan ion H⁺,
yang mempunyai pH < 7.
Asam memiliki rasa masam dan bersifat korosif.
Asam dapat mengubah warna indikator kertas lakmus biru menjadi merah.
10. B
Basa adalah senyawa yang bila dilarutkan dalam udara menghasilkan ion OH⁻
yang mempunyai pH > 7
Basa memiliki rasa pahit dan licin saat dilarutkan dalam air
Basa dapat mengubah warna indikator kertas lakmus merah menjadi biru.
53