Page 17 - Buku Pengayaan Elektrokimia
P. 17
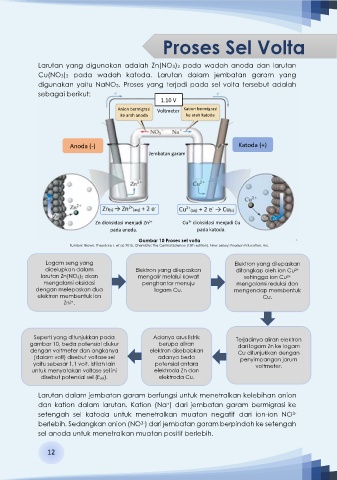
Proses Sel Volta
Larutan yang digunakan adalah Zn(NO3)2 pada wadah anoda dan larutan
Cu(NO3)2 pada wadah katoda. Larutan dalam jembatan garam yang
digunakan yaitu NaNO3. Proses yang terjadi pada sel volta tersebut adalah
sebagai berikut:
1.10 V
Anion bermigrasi Voltmeter Kation bermigrasi
ke arah anoda
ke arah katoda
Anoda (-) Katoda (+)
Jembatan garam
-
Zn(s) → Zn 2+ (aq) + 2 e - Cu 2+ (aq) + 2 e → Cu(s)
Zn dioksidasi menjadi Zn Cu dioksidasi menjadi Cu
2+
2+
pada anoda. pada katoda.
Gambar 10 Proses sel volta
Sumber: Brown, Theodore L. et al. 2015. Chemistry: The Central Science (13th edition). New Jersey: Pearson Education, Inc.
Logam seng yang Elektron yang dilepaskan
dicelupkan dalam
larutan Zn(NO3)2 akan Elektron yang dilepaskan ditangkap oleh ion Cu
2+
sehingga ion Cu
2+
mengalami oksidasi mengalir melalui kawat mengalami reduksi dan
penghantar menuju
dengan melepaskan dua logam Cu. mengendap membentuk
elektron membentuk ion Cu.
Zn .
2+
Seperti yang ditunjukkan pada Adanya arus listrik Terjadinya aliran elektron
gambar 10, beda potensial diukur berupa aliran dari logam Zn ke logam
dengan voltmeter dan angkanya elektron disebabkan Cu ditunjukkan dengan
(dalam volt) disebut voltase sel adanya beda penyimpangan jarum
yaitu sebesar 1,1 volt. Istilah lain potensial antara voltmeter.
untuk menyatakan voltase sel ini elektroda Zn dan
disebut potensial sel (Esel). elektroda Cu.
Larutan dalam jembatan garam berfungsi untuk menetralkan kelebihan anion
dan kation dalam larutan. Kation (Na ) dari jembatan garam bermigrasi ke
+
setengah sel katoda untuk menetralkan muatan negatif dari ion-ion NO
3-
berlebih. Sedangkan anion (NO ) dari jembatan garam berpindah ke setengah
3-
sel anoda untuk menetralkan muatan positif berlebih.
12