Page 29 - eBook Intan Fitriyanti Sahra UPI
P. 29
REAKSI
REDUKSI OKSIDASI
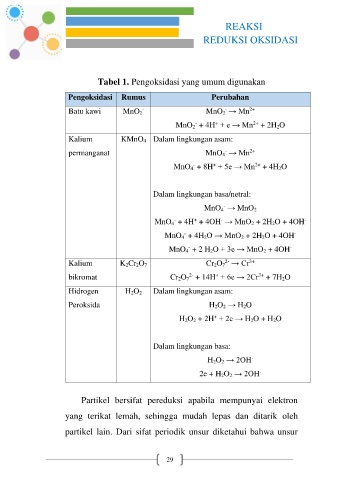
Tabel 1. Pengoksidasi yang umum digunakan
Pengoksidasi Rumus Perubahan
-
-
Batu kawi MnO 2 MnO 2 → Mn 2+
-
+
2+
MnO 2 + 4H + e → Mn + 2H 2O
Kalium KMnO 4 Dalam lingkungan asam:
-
permanganat MnO 4 → Mn 2+
2+
MnO 4 + 8H + 5e → Mn + 4H 2O
-
+
Dalam lingkungan basa/netral:
-
MnO 4 → MnO 2
-
+
-
MnO 4 + 4H + 4OH → MnO 2 + 2H 2O + 4OH -
-
MnO 4 + 4H 2O → MnO 2 + 2H 2O + 4OH -
-
-
MnO 4 + 2 H 2O + 3e → MnO 2 + 4OH
2-
Kalium K 2Cr 2O 7 Cr 2O 7 → Cr 3+
+
3+
2-
bikromat Cr 2O 7 + 14H + 6e → 2Cr + 7H 2O
Hidrogen H 2O 2 Dalam lingkungan asam:
Peroksida H 2O 2 → H 2O
+
H 2O 2 + 2H + 2e → H 2O + H 2O
Dalam lingkungan basa:
H 2O 2 → 2OH -
-
2e + H 2O 2 → 2OH
Partikel bersifat pereduksi apabila mempunyai elektron
yang terikat lemah, sehingga mudah lepas dan ditarik oleh
partikel lain. Dari sifat periodik unsur diketahui bahwa unsur
29