Page 38 - E-MODUL KIMIA REDOKS
P. 38
[Document title]
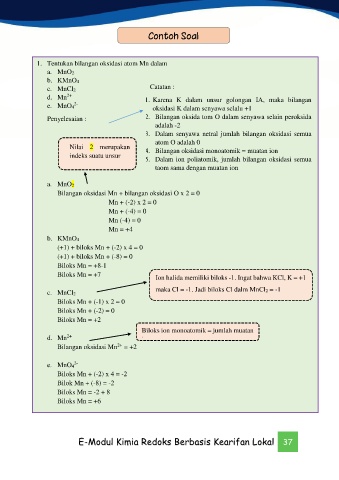
Contoh Soal
1. Tentukan bilangan oksidasi atom Mn dalam
a. MnO2
b. KMnO4
c. MnCl2 Catatan :
d. Mn 1. Karena K dalam unsur golongan IA, maka bilangan
2+
2-
e. MnO4 oksidasi K dalam senyawa selalu +1
Penyelesaian : 2. Bilangan oksida tom O dalam senyawa selain peroksida
adalah -2
3. Dalam senyawa netral jumlah bilangan oksidasi semua
Nilai 2 merupakan atom O adalah 0
indeks suatu unsur 4. Bilangan oksidasi monoatomik = muatan ion
5. Dalam ion poliatomik, jumlah bilangan oksidasi semua
taom sama dengan muatan ion
a. MnO2
Bilangan oksidasi Mn + bilangan oksidasi O x 2 = 0
Mn + (-2) x 2 = 0
Mn + (-4) = 0
Mn (-4) = 0
Mn = +4
b. KMnO4
(+1) + biloks Mn + (-2) x 4 = 0
(+1) + biloks Mn + (-8) = 0
Biloks Mn = +8-1
Biloks Mn = +7 Ion halida memiliki biloks -1. Ingat bahwa KCl, K = +1
c. MnCl2 maka Cl = -1. Jadi biloks Cl dalm MnCl2 = -1
Biloks Mn + (-1) x 2 = 0
Biloks Mn + (-2) = 0
Biloks Mn = +2
Biloks ion monoatomik = jumlah muatan
2+
d. Mn ion
2+
Bilangan oksidasi Mn = +2
2-
e. MnO4
Biloks Mn + (-2) x 4 = -2
Bilok Mn + (-8) = -2
Biloks Mn = -2 + 8
Biloks Mn = +6
E-Modul Kimia Redoks Berbasis Kearifan Lokal 37