Page 4 - Demo
P. 4
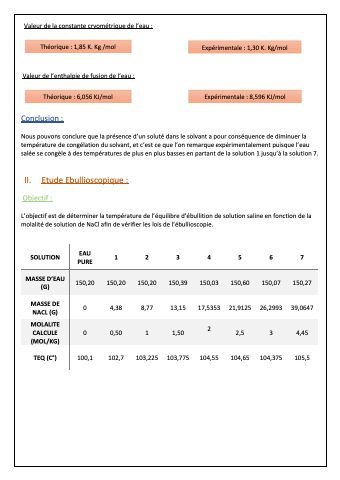
Valeur de la constante cryométrique de l’eau :
Théorique : 1,85 K. Kg /mol
Valeur de l’enthalpie de fusion de l’eau :
Conclusion :
Nous pouvons conclure que la présence d’un soluté dans le solvant a pour conséquence de diminuer la température de congélation du solvant, et c’est ce que l’on remarque expérimentalement puisque l’eau salée se congèle à des températures de plus en plus basses en partant de la solution 1 jusqu’à la solution 7.
II. Etude Ebullioscopique :
Objectif :
L’objectif est de déterminer la température de l’équilibre d’ébullition de solution saline en fonction de la molalité de solution de NaCl afin de vérifier les lois de l’ébullioscopie.
SOLUTION EAU 1 2 3 4 5 6 7 PURE
Expérimentale : 1,30 K. Kg/mol
Théorique : 6,056 KJ/mol
Expérimentale : 8,596 KJ/mol
MASSE D’EAU (G)
150,20 150,20 150,20 150,39 150,03 150,60 150,07 150,27
MASSE DE NACL (G)
0 4,38 8,77 13,15 17,5353 21,9125 26,2993 39,0647
MOLALITE CALCULE (MOL/KG)
0 0,50 1 1,50 2 2,5 3 4,45
TEQ (C°) 100,1 102,7 103,225 103,775 104,55 104,65 104,375 105,5