Page 40 - Technogenic_Ils_Yanin
P. 40
ды, одновременно с адсорбцией происходит так называемое соосаждение – процесс включения
растворенных в воде веществ в качестве второстепенного компонента в твердую разу в момент ее
осаждения, причем часто невозможно провести четкое различие между адсорбцией и соосаждени-
ем [176]. При высоком значении рН адсорбция может сопровождаться гидролизом [614].
Для выведения хи-
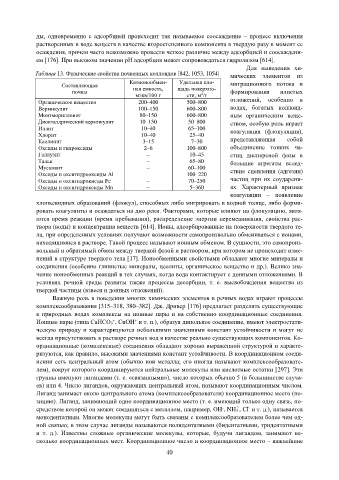
Таблица 13. Физические свойства почвенных коллоидов [842, 1053, 1054] мических элементов из
Катионообмен- Удельная пло-
Составляющая ная емкость, щадь поверхно- миграционного потока и
почвы формирования илистых
мэкв/100 г сти, м /г
2
Органическое вещество 200–400 500–800 отложений, особенно в
Вермикулит 100–150 600–800 водах, богатых коллоид-
Монтмориллонит 80–150 600–800 ным органическим веще-
Диоктаэдрический вермикулит 10–150 50–800 ством, особую роль играет
Иллит 10–40 65–100 коагуляция (флокуляция),
Хлорит 10–40 25–40
Каолинит 3–15 7–30 представляющая собой
Оксиды и гидроксиды 2–6 100–800 объединение тонких ча-
Галлузит – 10–45 стиц дисперсной фазы в
Тальк – 65–80 большие агрегаты вслед-
Мусковит – 60–100
Оксиды и оксигидрооксиды Al – 100–220 ствие сцепления (адгезии)
Оксиды и оксигидрокисды Fe – 70–250 частиц при их соударени-
Оксиды и оксигидроксиды Mn – 5–360 ях. Характерный признак
коагуляции – появление
хлопьевидных образований (флокул), способных либо мигрировать в водной толще, либо форми-
ровать коагулянты и осаждаться на дно реки. Факторами, которые влияют на флокуляцию, явля-
ются время реакции (время пребывания), распределение энергии перемешивания, свойства рас-
твора (воды) и концентрация веществ [614]. Ионы, адсорбированные на поверхности твердого те-
ла, при определенных условиях получают возможности самопроизвольно обмениваться с ионами,
находящимися в растворе. Такой процесс называют ионным обменом. В сущности, это самопроиз-
вольный и обратимый обмен между твердой фазой и раствором, при котором не происходит изме-
нений в структуре твердого тела [17]. Ионообменными свойствами обладают многие минералы и
соединения (особенно глинистые минералы, цеолиты, органическое вещество и др.). Велико зна-
чение ионообменных реакций в тех случаях, когда вода контактирует с донными отложениями. В
условиях речной среды развиты также процессы десорбции, т. е. высвобождения вещества из
твердой частицы (взвеси и донных отложений).
Важную роль в поведении многих химических элементов в речных водах играют процессы
комплексообразования [315–318, 380–382]. Дж. Дривер [176] предлагает разделять существующие
в природных водах комплексы на ионные пары и на собственно координационные соединения.
Ионные пары (типа CaHCO3 , CuOH и т. п.), образуя дипольное соединение, имеют электростати-
+
+
ческую природу и характеризуются небольшими значениями констант устойчивости и могут не
всегда присутствовать в растворе речных вод в качестве реально существующих компонентов. Ко-
ординационные (комплексные) соединения обладают хорошо выраженной структурой и характе-
ризуются, как правило, высокими значениями констант устойчивости. В координационном соеди-
нении есть центральный атом (обычно ион металла; его иногда называют комплексообразовате-
лем), вокруг которого координируются нейтральные молекулы или кислотные остатки [297]. Эти
группы именуют лигандами (т. е. «связанными»), число которых обычно 5 (в большинстве случа-
ев) или 4. Число лигандов, окружающих центральный атом, называют координационным числом.
Лиганд занимает около центрального атома (комплексообразователя) координационное место (по-
зицию). Лиганд, занимающий одно координационное место (т. е. имеющий только одну связь, по-
- - -
- - -
-
средством которой он может соединяться с металлом, например, ОН , NH3 , Cl и т. д.), называется
монодентатным. Многие молекулы могут быть связаны с комплексообразователем более чем од-
ной связью; в этом случае лиганды называются полидентатными (бидентатными, тридентатными
и т. д.). Известны сложные органические молекулы, которые, будучи лигандом, занимают не-
сколько координационных мест. Координационное число и координационное место – важнейшие
40