Page 12 - e-modul kesetimbangan kimia
P. 12
Ingat kembali pada bab laju reaksi, bahwa laju reaksi meningkat dengan meningkarnya
konsentrasi reaktan dan menurun dengan turunnya konsentrasi reaktan (kecuali pada
orde reaksi nol). Oleh karena itu reaksi antara hidrogen dan Iodium berjalan sebagai
berikut:
H + I 2HI
2 (g)
2 (g)
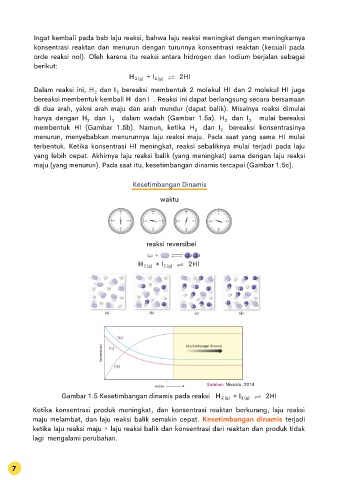
Dalam reaksi ini, H dan I bereaksi membentuk 2 molekul HI dan 2 molekul HI juga
2
2
bereaksi membentuk kembali H dan I . Reaksi ini dapat berlangsung secara bersamaan
di dua arah, yakni arah maju dan arah mundur (dapat balik). Misalnya reaksi dimulai
hanya dengan H dan I dalam wadah (Gambar 1.5a). H dan I mulai bereaksi
2
2
2
2
membentuk HI (Gambar 1.5b). Namun, ketika H dan I bereaksi konsentrasinya
2
2
menurun, menyebabkan menurunnya laju reaksi maju. Pada saat yang sama HI mulai
terbentuk. Ketika konsentrasi HI meningkat, reaksi sebaliknya mulai terjadi pada laju
yang lebih cepat. Akhirnya laju reaksi balik (yang meningkat) sama dengan laju reaksi
maju (yang menurun). Pada saat itu, kesetimbangan dinamis tercapai (Gambar 1.5c).
Kesetimbangan Dinamis
waktu
reaksi reversibel
H + I 2HI
2 (g)
2 (g)
konsentrasi kesetimbangan dinamis
Sumber: Nivaldo, 2014
waktu
Gambar 1.5 Kesetimbangan dinamis pada reaksi 2HI
+ I 2 (g)
H 2 (g)
Ketika konsentrasi produk meningkat, dan konsentrasi reaktan berkurang, laju reaksi
maju melambat, dan laju reaksi balik semakin cepat. Kesetimbangan dinamis terjadi
ketika laju reaksi maju = laju reaksi balik dan konsentrasi dari reaktan dan produk tidak
lagi mengalami perubahan.
7