Page 35 - Prototype E-Modul Pembelajaran Berbasis Intertekstual pada Konsep Penurunan Tekanan Uap
P. 35
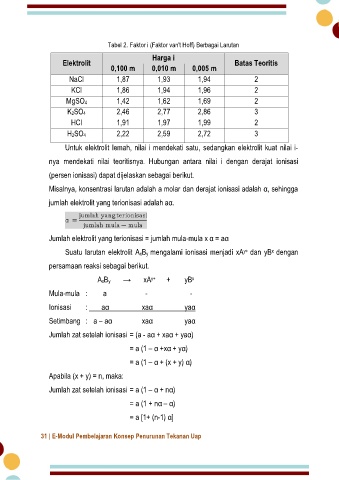
Tabel 2. Faktor i (Faktor van't Hoff) Berbagai Larutan
Harga i
Elektrolit Batas Teoritis
0,100 m 0,010 m 0,005 m
NaCl 1,87 1,93 1,94 2
KCl 1,86 1,94 1,96 2
MgSO4 1,42 1,62 1,69 2
K2SO4 2,46 2,77 2,86 3
HCl 1,91 1,97 1,99 2
H2SO4 2,22 2,59 2,72 3
Untuk elektrolit lemah, nilai i mendekati satu, sedangkan elektrolit kuat nilai i-
nya mendekati nilai teoritisnya. Hubungan antara nilai i dengan derajat ionisasi
(persen ionisasi) dapat dijelaskan sebagai berikut.
Misalnya, konsentrasi larutan adalah a molar dan derajat ionisasi adalah α, sehingga
jumlah elektrolit yang terionisasi adalah aα.
Jumlah elektrolit yang terionisasi = jumlah mula-mula x α = aα
Suatu larutan elektrolit AxBy mengalami ionisasi menjadi xA dan yB dengan
x
y+
persamaan reaksi sebagai berikut.
AxBy → xA + yB
x
y+
Mula-mula : a - -
Ionisasi : aα xaα yaα
Setimbang : a – aα xaα yaα
Jumlah zat setelah ionisasi = (a - aα + xaα + yaα)
= a (1 – α +xα + yα)
= a (1 – α + (x + y) α)
Apabila (x + y) = n, maka:
Jumlah zat setelah ionisasi = a (1 – α + nα)
= a (1 + nα – α)
= a [1+ (n-1) α]
31 | E-Modul Pembelajaran Konsep Penurunan Tekanan Uap