Page 5 - BAB III - IKATAN KIMIA
P. 5
IKATAN KIMIA
3. Ikatan Kimia
Di alam materi terdapat dalam bentuk molekul, hanya sedikit yang berada dalam
bentuk atom bebas. Tahukah anda mengapa? Beberapa molekul terbebtuk dari atom-
atom sejenis, seperti hidrogen (H2), klorin (Cl2) dan belerang (S8). Ada pula molekul yang
terbentuk dari atom-atom berbeda, misalnya air (H2O), dan Karbon dioksida (CO2).
Molekul-molekul tersebut terbentuk dari atom-atom yang saling berikatan. Jadi definisi
ikatan kimia merupakan ikatan dalam interaksi gaya tarik menarik antar dua atom atau
molekul yang menyebabkan suatu senyawa menjadi stabil.
3.1 Kestabilan Unsur Atom
Atom-atom dapat dikelompokkan menjadi atom logam, nonlogam, metaloid dan
gas mulia. Atom-atom gas mulia bersifat stabil, sedangkan atom-atom lainnya bersifat
tidak stabil karena kulit terluarnya terisi penuh oleh elektron. Adapun kestabilan unsur-
unsur gas mulia (Ne, Ar, Kr, Xe, dan Rn) terkait dengan konfigurasi elektronnya, terutama
elektron valensinya yang berjumlah 8 kecuali untuk Helium sebanyak 2 elekton.
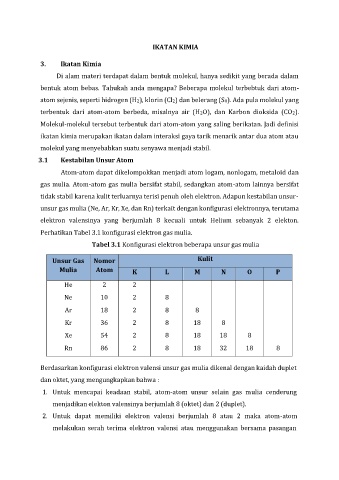
Perhatikan Tabel 3.1 konfigurasi elektron gas mulia.
Tabel 3.1 Konfigurasi elektron beberapa unsur gas mulia
Unsur Gas Nomor Kulit
Mulia Atom K L M N O P
He 2 2
Ne 10 2 8
Ar 18 2 8 8
Kr 36 2 8 18 8
Xe 54 2 8 18 18 8
Rn 86 2 8 18 32 18 8
Berdasarkan konfigurasi elektron valensi unsur gas mulia dikenal dengan kaidah duplet
dan oktet, yang mengungkapkan bahwa :
1. Untuk mencapai keadaan stabil, atom-atom unsur selain gas mulia cenderung
menjadikan elekton valensinya berjumlah 8 (oktet) dan 2 (duplet).
2. Untuk dapat memiliki elektron valensi berjumlah 8 atau 2 maka atom-atom
melakukan serah terima elektron valensi atau menggunakan bersama pasangan