Page 7 - BAB III - IKATAN KIMIA
P. 7
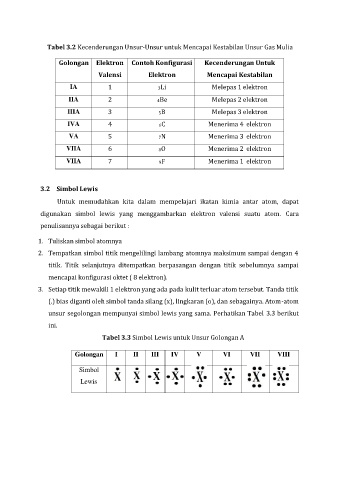
Tabel 3.2 Kecenderungan Unsur-Unsur untuk Mencapai Kestabilan Unsur Gas Mulia
Golongan Elektron Contoh Konfigurasi Kecenderungan Untuk
Valensi Elektron Mencapai Kestabilan
IA 1 3Li Melepas 1 elektron
IIA 2 4Be Melepas 2 elektron
IIIA 3 5B Melepas 3 elektron
IVA 4 6C Menerima 4 elektron
VA 5 7N Menerima 3 elektron
VIIA 6 8O Menerima 2 elektron
VIIA 7 9F Menerima 1 elektron
3.2 Simbol Lewis
Untuk memudahkan kita dalam mempelajari ikatan kimia antar atom, dapat
digunakan simbol lewis yang menggambarkan elektron valensi suatu atom. Cara
penulisannya sebagai berikut :
1. Tuliskan simbol atomnya
2. Tempatkan simbol titik mengelilingi lambang atomnya maksimum sampai dengan 4
titik. Titik selanjutnya ditempatkan berpasangan dengan titik sebelumnya sampai
mencapai konfigurasi oktet ( 8 elektron).
3. Setiap titik mewakili 1 elektron yang ada pada kulit terluar atom tersebut. Tanda titik
(.) bias diganti oleh simbol tanda silang (x), lingkaran (o), dan sebagainya. Atom-atom
unsur segolongan mempunyai simbol lewis yang sama. Perhatikan Tabel 3.3 berikut
ini.
Tabel 3.3 Simbol Lewis untuk Unsur Golongan A
Golongan I II III IV V VI VII VIII
Simbol
Lewis