Page 8 - Ebook Rayhan Jamilah fixeddd
P. 8
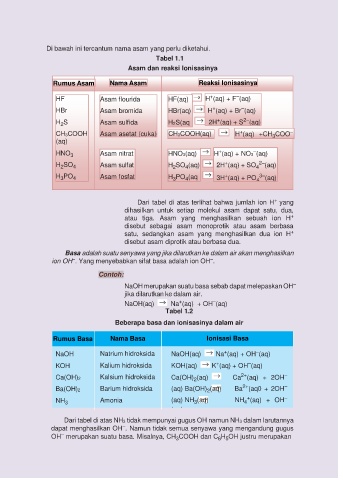
Di bawah ini tercantum nama asam yang perlu diketahui.
Tabel 1.1
Asam dan reaksi Ionisasinya
Rumus Asam Nama Asam Reaksi Ionisasinya
+
–
HF Asam flourida HF(aq) H (aq) + F (aq)
–
+
HBr Asam bromida HBr(aq) H (aq) + Br (aq)
+
2–
H S Asam sulfida H2S(aq 2H (aq) + S (aq)
2
)
–
+
CH3COOH Asam asetat (cuka) CH3COOH(aq) H (aq) +CH COO
3
(aq)
+
–
HNO 3 Asam nitrat HNO3(aq) H (aq) + NO3 (aq)
+
H SO 4 Asam sulfat H SO (aq) 2H (aq) + SO 4 2– (aq)
2
2
4
+
H PO Asam fosfat H PO (aq 3H (aq) + PO 3– (aq)
4
3
4
3
) 4
+
Dari tabel di atas terlihat bahwa jumlah ion H yang
dihasilkan untuk setiap molekul asam dapat satu, dua,
atau tiga. Asam yang menghasilkan sebuah ion H +
disebut sebagai asam monoprotik atau asam berbasa
satu, sedangkan asam yang menghasilkan dua ion H +
disebut asam diprotik atau berbasa dua.
Basa adalah suatu senyawa yang jika dilarutkan ke dalam air akan menghasilkan
–
–
ion OH . Yang menyebabkan sifat basa adalah ion OH .
Contoh:
NaOH merupakan suatu basa sebab dapat melepaskan OH –
jika dilarutkan ke dalam air.
+
–
NaOH(aq) Na (aq) + OH (aq)
Tabel 1.2
Beberapa basa dan ionisasinya dalam air
Rumus Basa Nama Basa Ionisasi Basa
–
+
NaOH Natrium hidroksida NaOH(aq) Na (aq) + OH (aq)
+
–
KOH Kalium hidroksida KOH(aq) K (aq) + OH (aq)
2+
Ca(OH)2 Kalsium hidroksida Ca(OH) (aq) Ca (aq) + 2OH –
2
2+
Ba(OH)2 Barium hidroksida (aq) Ba(OH) (aq) Ba (aq0 + 2OH –
2
+
NH Amonia (aq) NH (aq) NH (aq) + OH –
4
3
3
(aq)
Dari tabel di atas NH3 tidak mempunyai gugus OH namun NH3 dalam larutannya
–
dapat menghasilkan OH . Namun tidak semua senyawa yang mengandung gugus
–
OH merupakan suatu basa. Misalnya, CH COOH dan C H OH justru merupakan
6 5
3