Page 20 - B. PESERTA DIDIK pelatihan
P. 20
Tahukah Kalian
Dalam melepaskan elektron
pastinya diperlukan energi. Energi yang Energi ionisasi dapat ditentukan secara
diperlukan untuk mengeluarkan satu eksperimen dengan menempatkan spesies gas
elektron tiap mol dalam keadaan gas di dalam tabung, kemudian tegangan (voltase)
disebut sebagai energi ionisasi. Energi dalam tabung dinaikan secara perlahan, praktis
yang diperlukan untuk melepaskan satu tidak ada arus listrik sampai dengan harga
voltase tertentu pada saat sebuah elektron
elektron pertama dari atom netralnya dilepaskan oleh spesies yang bersangkutan.
disebut sebagai energi ionisasi pertama Harga voltase pada saat mulai terjadinya arus
dan untuk mengeluarkan satu elektron ke listrik inilah yang didefinisikan sebagai energi
dua disebut sebagai energi ionisasi ke ionisasi. Oleh karena itu, energi ionisasi
dua, demikian seterusnya untuk biasanya dinyatakan dengan satuan non SI,
pengeluaran elektron selanjutnya. elektron volt, eV dan sering pula disebut
Perhatikan Tabel 2 di bawah ini. sebagai potensial ionisasi
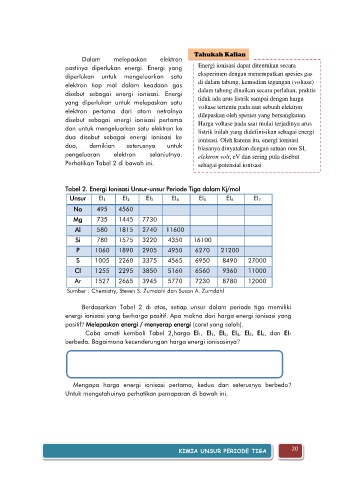
Tabel 2. Energi Ionisasi Unsur-unsur Periode Tiga dalam Kj/mol
Unsur EI 1 EI 2 EI 3 EI 4 EI 5 EI 6 EI 7
Na 495 4560
Mg 735 1445 7730
Al 580 1815 2740 11600
Si 780 1575 3220 4350 16100
P 1060 1890 2905 4950 6270 21200
S 1005 2260 3375 4565 6950 8490 27000
Cl 1255 2295 3850 5160 6560 9360 11000
Ar 1527 2665 3945 5770 7230 8780 12000
Sumber : Chemistry, Steven S. Zumdahl dan Susan A. Zumdahl
Berdasarkan Tabel 2 di atas, setiap unsur dalam periode tiga memiliki
energi ionisasi yang berharga positif. Apa makna dari harga energi ionisasi yang
positif? Melepaskan energi / menyerap energi (coret yang salah).
Coba amati kembali Tabel 2,harga EI 1, EI 2, EI 3, EI 4, EI 5, EI 6, dan EI 7
berbeda. Bagaimana kecenderungan harga energi ionisasinya?
Mengapa harga energi ionisasi pertama, kedua dan seterusnya berbeda?
Untuk mengetahuinya perhatikan pemaparan di bawah ini.
KIMIA UNSUR PERIODE TIGA 20