Page 22 - B. PESERTA DIDIK pelatihan
P. 22
b. Berdasarkan jawaban soal a, bagaimana mudah tidaknya suatu unsur dalam
melepaskan satu elektrondari unsur Na sampai unsur Ar?
c. Berdasarkan jari-jari atom unsur-unsur periode tiga bagaimana
kecenderungan energi ionisasi unsur-unsur periode tiga dari unsur Na hingga
unsur Ar?
Pada unsur-unsur logam harga energi ionisasi cenderung kecil sedangkan
pada unsur-unsur nonlogam harga energi ionisasi cenderung besar. Berdasarkan
Tabel 2, harga energi ionisasi pertama pada unsur-unsur periode tiga memiliki
kecenderungan meningkat namun, tidak terjadi diantara unsur Mg dan Al serta
unsur P dan S. Mengapa demikian? Untuk mengetahuinya coba tuliskan
konfigurasi elektron unsur Mg, Al, P, dan S serta isilah bagian rumpang pada
kalimat-kalimat di bawahnya.
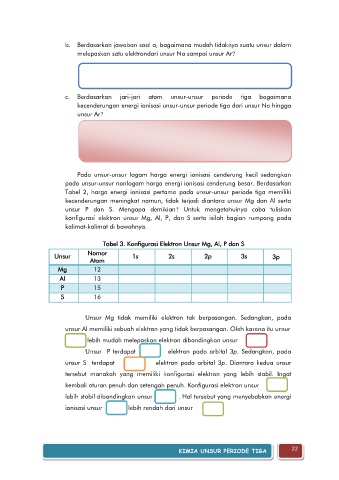
Tabel 3. Konfigurasi Elektron Unsur Mg, Al, P dan S
Nomor
Unsur 1s 2s 2p 3s 3p
Atom
Mg 12
Al 13
P 15
S 16
Unsur Mg tidak memiliki elektron tak berpasangan. Sedangkan, pada
unsur Al memiliki sebuah elektron yang tidak berpasangan. Oleh karena itu unsur
lebih mudah melepaskan elektron dibandingkan unsur .
Unsur P terdapat elektron pada orbital 3p. Sedangkan, pada
unsur S terdapat elektron pada orbital 3p. Diantara kedua unsur
tersebut manakah yang memiliki konfigurasi elektron yang lebih stabil. Ingat
kembali aturan penuh dan setengah penuh. Konfigurasi elektron unsur
lebih stabil dibandingkan unsur . Hal tersebut yang menyebabkan energi
ionisasi unsur lebih rendah dari unsur .
KIMIA UNSUR PERIODE TIGA 22