Page 27 - B. PESERTA DIDIK pelatihan
P. 27
6. Daya Oksidasi dan Daya Reduksi
Masih ingatkah kalian dengan potensial elektroda standar? Bagaimana
cara menghitung potensial elektroda standar? Tahukah kalian bahwa berdasarkan
perjanjian internasional, potensial elektroda standar disusun berdasarkan
setengah reaksi reduksinya? Oleh karena itu, potensial elektrode standar disebut
0
sebagai potensial reduksi standar (E reduksi). Coba perhatikan Tabel 6 di bawah ini.
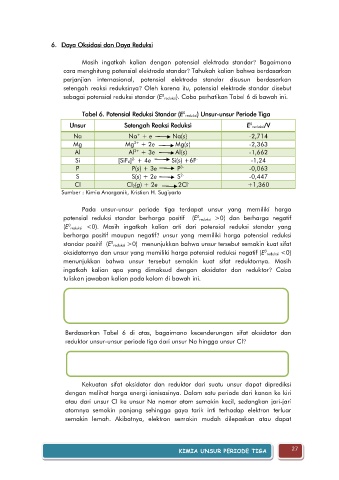
Tabel 6. Potensial Reduksi Standar (E reduksi) Unsur-unsur Periode Tiga
0
Unsur Setengah Reaksi Reduksi E reduksi/V
0
+
Na Na + e Na(s) -2,714
Mg Mg + 2e Mg(s) -2,363
2+
Al Al + 3e Al(s) -1,662
3+
-
2-
Si [SiF 6] + 4e Si(s) +6F -1,24
P P(s) + 3e P -0,063
3-
2-
S S(s) + 2e S -0,447
Cl Cl 2(g) + 2e 2Cl +1,360
-
Sumber : Kimia Anorganik, Kristian H. Sugiyarto
Pada unsur-unsur periode tiga terdapat unsur yang memiliki harga
potensial reduksi standar berharga positif (E reduksi >0) dan berharga negatif
0
(E reduksi <0). Masih ingatkah kalian arti dari potensial reduksi standar yang
0
berharga positif maupun negatif? unsur yang memiliki harga potensial reduksi
0
standar positif (E reduksi >0) menunjukkan bahwa unsur tersebut semakin kuat sifat
oksidatornya dan unsur yang memiliki harga potensial reduksi negatif (E reduksi <0)
0
menunjukkan bahwa unsur tersebut semakin kuat sifat reduktornya. Masih
ingatkah kalian apa yang dimaksud dengan oksidator dan reduktor? Coba
tuliskan jawaban kalian pada kolom di bawah ini.
Berdasarkan Tabel 6 di atas, bagaimana kecenderungan sifat oksidator dan
reduktor unsur-unsur periode tiga dari unsur Na hingga unsur Cl?
Kekuatan sifat oksidator dan reduktor dari suatu unsur dapat diprediksi
dengan melihat harga energi ionisasinya. Dalam satu periode dari kanan ke kiri
atau dari unsur Cl ke unsur Na nomor atom semakin kecil, sedangkan jari-jari
atomnya semakin panjang sehingga gaya tarik inti terhadap elektron terluar
semakin lemah. Akibatnya, elektron semakin mudah dilepaskan atau dapat
KIMIA UNSUR PERIODE TIGA 27