Page 28 - B. PESERTA DIDIK pelatihan
P. 28
dikatakan bahwa oksidasi semakin mudah terjadi. Oleh karena itu, sifat reduktor
semakin kuat.
7. Kelektronegatifan
Istilah keelektronegatifan pertama kali dikemukakan oleh Linus Pauling.
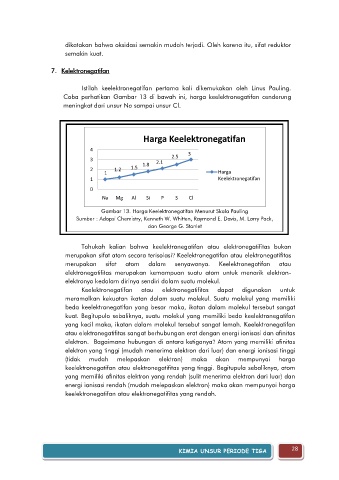
Coba perhatikan Gambar 13 di bawah ini, harga keelektronegatifan cenderung
meningkat dari unsur Na sampai unsur Cl.
Harga Keelektronegatifan
4
3 2.5 3
2 1.2 1.5 1.8 2.1
1 Harga
1 Keelektronegatifan
0
Na Mg Al Si P S Cl
Gambar 13. Harga Keelektronegatifan Menurut Skala Pauling
Sumber : Adopsi Chemistry, Kenneth W. Whitten, Raymond E. Davis, M. Larry Pack,
dan George G. Stanlet
Tahukah kalian bahwa keelektronegatifan atau elektronegatifitas bukan
merupakan sifat atom secara terisolasi? Keelektronegatifan atau elektronegatifitas
merupakan sifat atom dalam senyawanya. Keelektronegatifan atau
elektronegatifitas merupakan kemampuan suatu atom untuk menarik elektron-
elektronya kedalam dirinya sendiri dalam suatu molekul.
Keelektronegatifan atau elektronegatifitas dapat digunakan untuk
meramalkan kekuatan ikatan dalam suatu molekul. Suatu molekul yang memiliki
beda keelektronegatifan yang besar maka, ikatan dalam molekul tersebut sangat
kuat. Begitupula sebaliknya, suatu molekul yang memiliki beda keelektronegatifan
yang kecil maka, ikatan dalam molekul tersebut sangat lemah. Keelektronegatifan
atau elektronegatifitas sangat berhubungan erat dengan energi ionisasi dan afinitas
elektron. Bagaimana hubungan di antara ketiganya? Atom yang memiliki afinitas
elektron yang tinggi (mudah menerima elektron dari luar) dan energi ionisasi tinggi
(tidak mudah melepaskan elektron) maka akan mempunyai harga
keelektronegatifan atau elektronegatifitas yang tinggi. Begitupula sebaliknya, atom
yang memiliki afinitas elektron yang rendah (sulit menerima elektron dari luar) dan
energi ionisasi rendah (mudah melepaskan elektron) maka akan mempunyai harga
keelektronegatifan atau elektronegatifitas yang rendah.
KIMIA UNSUR PERIODE TIGA 28