Page 52 - KII - Quimica
P. 52
Química 3° Secundaria
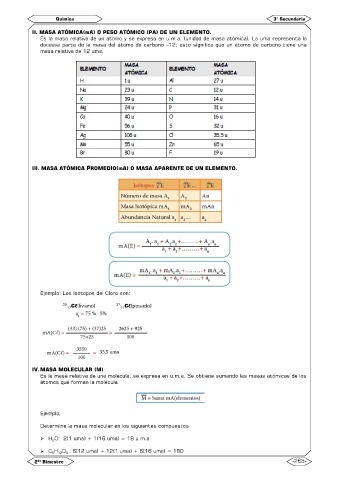
II. MASA ATÓMICA(mA) O PESO ATÓMICO (PA) DE UN ELEMENTO.
Es la masa relativa de un átomo y se expresa en u.m.a. (unidad de masa atómica). La uma representa la
doceava parte de la masa del átomo de carbono –12; esto significa que un átomo de carbono tiene una
masa relativa de 12 uma.
III. MASA ATÓMICA PROMEDIO(mA) O MASA APARENTE DE UN ELEMENTO.
Ejemplo: Los Isótopos del Cloro son:
35 17 Cℓ(liviano) 37 17 Cℓ(pesado)
IV. MASA MOLECULAR (M)
Es la masa relativa de una molécula, se expresa en u.m.a. Se obtiene sumando las masas atómicas de los
átomos que forman la molécula.
Ejemplo.
Determine la masa molecular en los siguientes compuestos
H O: 2(1 uma) + 1(16 uma) = 18 u.m.a
2
C H O : 6(12 uma) + 12(1 uma) + 6(16 uma) = 180
6
6
12
do
2 Bimestre -265-