Page 383 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 383
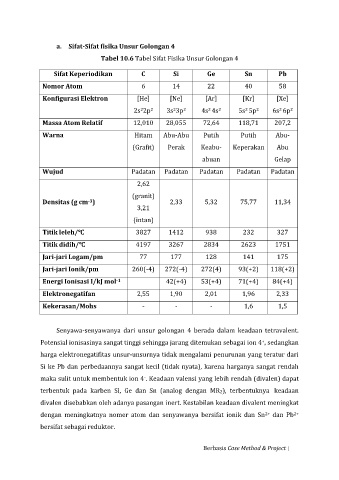
a. Sifat-Sifat fisika Unsur Golongan 4
Tabel 10.6 Tabel Sifat Fisika Unsur Golongan 4
Sifat Keperiodikan C Si Ge Sn Pb
Nomor Atom 6 14 22 40 58
Konfigurasi Elektron [He] [Ne] [Ar] [Kr] [Xe]
2
2
2
2
2
2
2
2
2
2
2s 2p 3s 3p 4s 4s 5s 5p 6s 6p
Massa Atom Relatif 12,010 28,055 72,64 118,71 207,2
Warna Hitam Abu-Abu Putih Putih Abu-
(Grafit) Perak Keabu- Keperakan Abu
abuan Gelap
Wujud Padatan Padatan Padatan Padatan Padatan
2,62
(granit)
Densitas (g cm ) 2,33 5,32 75,77 11,34
-3
3,21
(intan)
Titik leleh/℃ 3827 1412 938 232 327
Titik didih/℃ 4197 3267 2834 2623 1751
Jari-jari Logam/pm 77 177 128 141 175
Jari-jari Ionik/pm 260(-4) 272(-4) 272(4) 93(+2) 118(+2)
Energi Ionisasi I/kJ mol 42(+4) 53(+4) 71(+4) 84(+4)
-1
Elektronegatifan 2,55 1,90 2,01 1,96 2,33
Kekerasan/Mohs - - - 1,6 1,5
Senyawa-senyawanya dari unsur golongan 4 berada dalam keadaan tetravalent.
Potensial ionisasinya sangat tinggi sehingga jarang ditemukan sebagai ion 4 , sedangkan
+
harga elektronegatifitas unsur-unsurnya tidak mengalami penurunan yang teratur dari
Si ke Pb dan perbedaannya sangat kecil (tidak nyata), karena harganya sangat rendah
maka sulit untuk membentuk ion 4 . Keadaan valensi yang lebih rendah (divalen) dapat
-
terbentuk pada karben Si, Ge dan Sn (analog dengan MR2), terbentuknya keadaan
divalen disebabkan oleh adanya pasangan inert. Kestabilan keadaan divalent meningkat
dengan meningkatnya nomer atom dan senyawanya bersifat ionik dan Sn 2+ dan Pb 2+
bersifat sebagai reduktor.
Berbasis Case Method & Project |
359