Page 396 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 396
senyawa, melainkan dalam bentuk atom-atom dan disebut sebagai unsur bebas. Hal ini
menunjukkan bahwal gas mulia sukar bereaksi dengan unsur lain, karena susunan
electron gas mulia telah stabil. Gas mulia memiliki 8 elektron valensi (octet) kecuali
helium dengan electron valensi (duplet).
a. Sifat-Sifat Fisika Unsur Golongan 8
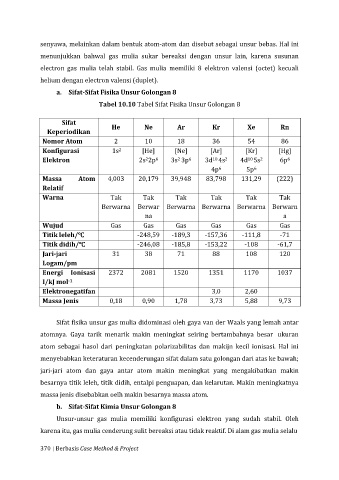
Tabel 10.10 Tabel Sifat Fisika Unsur Golongan 8
Sifat
Keperiodikan He Ne Ar Kr Xe Rn
Nomor Atom 2 10 18 36 54 86
Konfigurasi 1s [He] [Ne] [Ar] [Kr] [Hg]
2
Elektron 2s 2p 3s 3p 3d 4s 4d 5s 6p
6
2
10
2
2
2
6
6
10
6
6
4p 5p
Massa Atom 4,003 20,179 39,948 83,798 131,29 (222)
Relatif
Warna Tak Tak Tak Tak Tak Tak
Berwarna Berwar Berwarna Berwarna Berwarna Berwarn
na a
Wujud Gas Gas Gas Gas Gas Gas
Titik leleh/℃ -248,59 -189,3 -157,36 -111,8 -71
Titik didih/℃ -246,08 -185,8 -153,22 -108 -61,7
Jari-jari 31 38 71 88 108 120
Logam/pm
Energi Ionisasi 2372 2081 1520 1351 1170 1037
-1
I/kJ mol
Elektronegatifan 3,0 2,60
Massa Jenis 0,18 0,90 1,78 3,73 5,88 9,73
Sifat fisika unsur gas mulia didominasi oleh gaya van der Waals yang lemah antar
atomnya. Gaya tarik menarik makin meningkat seiring bertambahnya besar ukuran
atom sebagai hasol dari peningkatan polarizabilitas dan makijn kecil ionisasi. Hal ini
menyebabkan keteraturan kecenderungan sifat dalam satu golongan dari atas ke bawah;
jari-jari atom dan gaya antar atom makin meningkat yang mengakibatkan makin
besarnya titik leleh, titik didih, entalpi penguapan, dan kelarutan. Makin meningkatnya
massa jenis disebabkan oelh makin besarnya massa atom.
b. Sifat-Sifat Kimia Unsur Golongan 8
Unsur-unsur gas mulia memiliki konfigurasi elektron yang sudah stabil. Oleh
karena itu, gas mulia cenderung sulit bereaksi atau tidak reaktif. Di alam gas mulia selalu
370 | Berbasis Case Method & Project