Page 400 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 400
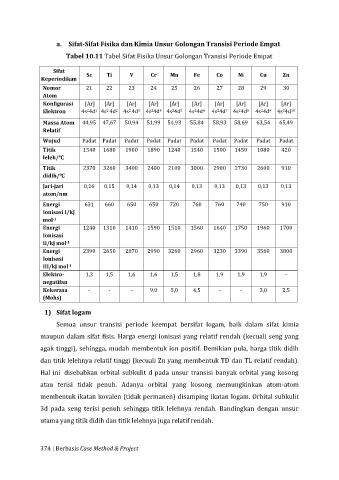
a. Sifat-Sifat Fisika dan Kimia Unsur Golongan Transisi Periode Empat
Tabel 10.11 Tabel Sifat Fisika Unsur Golongan Transisi Periode Empat
Sifat
Keperiodikan Sc Ti V Cr Mn Fe Co Ni Cu Zn
Nomor 21 22 23 24 25 26 27 28 29 30
Atom
Konfigurasi [Ar] [Ar] [Ar] [Ar] [Ar] [Ar] [Ar] [Ar] [Ar] [Ar]
Elektron 4s 4d 4s 4d 4s 4d 4s 4d 4s 4d 4s 4d 4s 4d 4s 4d 4s 4d 4s 4d 10
1
2
2
5
3
2
2
2
2
9
2
7
2
2
2
6
4
2
8
Massa Atom 44,95 47,67 50,94 51,99 54,93 55,84 58,93 58,69 63,54 65,49
Relatif
Wujud Padat Padat Padat Padat Padat Padat Padat Padat Padat Padat
Titik 1540 1680 1900 1890 1240 1540 1500 1450 1080 420
leleh/℃
Titik 2370 3260 3400 2480 2100 3000 2900 2730 2600 910
didih/℃
Jari-jari 0,16 0,15 0,14 0,13 0,14 0,13 0,13 0,13 0,13 0,13
atom/nm
Energi 631 660 650 650 720 760 760 740 750 910
Ionisasi I/kJ
-1
mol
Energi 1240 1310 1410 1590 1510 1560 1640 1750 1960 1700
Ionisasi
-1
II/kJ mol
Energi 2390 2650 2870 2990 3260 2960 3230 3390 3560 3800
Ionisasi
-1
III/kJ mol
Elektro- 1,3 1,5 1,6 1,6 1,5 1,8 1,9 1,9 1,9 -
negatifan
Kekerasa - - - 9,0 5,0 4,5 - - 3,0 2,5
(Mohs)
1) Sifat logam
Semua unsur transisi periode keempat bersifat logam, baik dalam sifat kimia
maupun dalam sifat fisis. Harga energi ionisasi yang relatif rendah (kecuali seng yang
agak tinggi), sehingga, mudah membentuk ion positif. Demikian pula, harga titik didih
dan titik lelehnya relatif tinggi (kecuali Zn yang membentuk TD dan TL relatif rendah).
Hal ini disebabkan orbital subkulit d pada unsur transisi banyak orbital yang kosong
atau terisi tidak penuh. Adanya orbital yang kosong memungkinkan atom-atom
membentuk ikatan kovalen (tidak permanen) disamping ikatan logam. Orbital subkulit
3d pada seng terisi penuh sehingga titik lelehnya rendah. Bandingkan dengan unsur
utama yang titik didih dan titik lelehnya juga relatif rendah.
374 | Berbasis Case Method & Project