Page 48 - E-Modul Termodinamika
P. 48
TERMODINAMIKA
yang diberikan sama dengan usaha yang dilakukan sistem (Q = W). kerja yang dilakukan system
2
= ∫ , gas ideal = maka:
1
2 2
= ∫ maka harga =
1 1
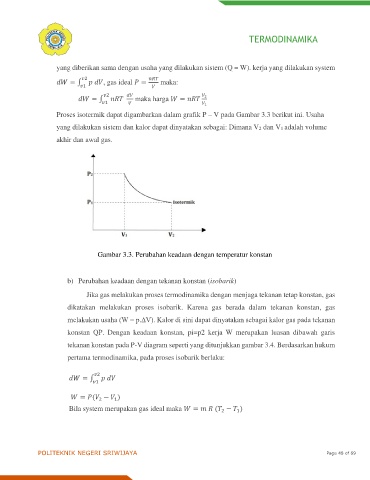
Proses isotermik dapat digambarkan dalam grafik P – V pada Gambar 3.3 berikut ini. Usaha
yang dilakukan sistem dan kalor dapat dinyatakan sebagai: Dimana V2 dan V1 adalah volume
akhir dan awal gas.
Gambar 3.3. Perubahan keadaan dengan temperatur konstan
b) Perubahan keadaan dengan tekanan konstan (isobarik)
Jika gas melakukan proses termodinamika dengan menjaga tekanan tetap konstan, gas
dikatakan melakukan proses isobarik. Karena gas berada dalam tekanan konstan, gas
melakukan usaha (W = p.∆V). Kalor di sini dapat dinyatakan sebagai kalor gas pada tekanan
konstan QP. Dengan keadaan konstan, pi=p2 kerja W merupakan luasan dibawah garis
tekanan konstan pada P-V diagram seperti yang ditunjukkan gambar 3.4. Berdasarkan hukum
pertama termodinamika, pada proses isobarik berlaku:
2
= ∫
1
= ( − )
2
1
Bila system merupakan gas ideal maka = ( − )
2
1
POLITEKNIK NEGERI SRIWIJAYA Page 48 of 69