Page 13 - Bahan Ajar Materi Asam Basa untuk Kelas XI IPA
P. 13
Setelah Anda mengklasifikasikan berbagai produk asam-basa, selanjutnya
perhatikan ciri-ciri zat asam-basa secara umum pada Tabel 2.
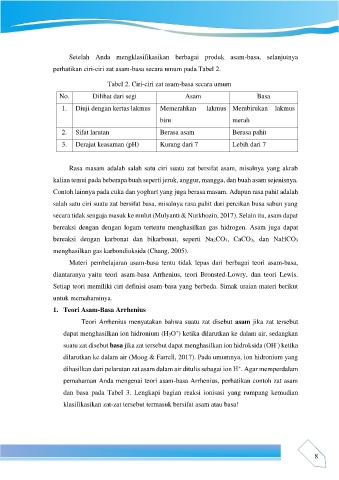
Tabel 2. Ciri-ciri zat asam-basa secara umum
No. Dilihat dari segi Asam Basa
1. Diuji dengan kertas lakmus Memerahkan lakmus Membirukan lakmus
biru merah
2. Sifat larutan Berasa asam Berasa pahit
3. Derajat keasaman (pH) Kurang dari 7 Lebih dari 7
Rasa masam adalah salah satu ciri suatu zat bersifat asam, misalnya yang akrab
kalian temui pada beberapa buah seperti jeruk, anggur, mangga, dan buah asam sejenisnya.
Contoh lainnya pada cuka dan yoghurt yang juga berasa masam. Adapun rasa pahit adalah
salah satu ciri suatu zat bersifat basa, misalnya rasa pahit dari percikan busa sabun yang
secara tidak sengaja masuk ke mulut (Mulyanti & Nurkhozin, 2017). Selain itu, asam dapat
bereaksi dengan dengan logam tertentu menghasilkan gas hidrogen. Asam juga dapat
bereaksi dengan karbonat dan bikarbonat, seperti Na2CO3, CaCO3, dan NaHCO3
menghasilkan gas karbondioksida (Chang, 2005).
Materi pembelajaran asam-basa tentu tidak lepas dari berbagai teori asam-basa,
diantaranya yaitu teori asam-basa Arrhenius, teori Bronsted-Lowry, dan teori Lewis.
Setiap teori memiliki ciri definisi asam-basa yang berbeda. Simak uraian materi berikut
untuk memahaminya.
1. Teori Asam-Basa Arrhenius
Teori Arrhenius menyatakan bahwa suatu zat disebut asam jika zat tersebut
+
dapat menghasilkan ion hidronium (H3O ) ketika dilarutkan ke dalam air, sedangkan
-
suatu zat disebut basa jika zat tersebut dapat menghasilkan ion hidroksida (OH ) ketika
dilarutkan ke dalam air (Moog & Farrell, 2017). Pada umumnya, ion hidronium yang
+
dihasilkan dari pelarutan zat asam dalam air ditulis sebagai ion H . Agar memperdalam
pemahaman Anda mengenai teori asam-basa Arrhenius, perhatikan contoh zat asam
dan basa pada Tabel 3. Lengkapi bagian reaksi ionisasi yang rumpang kemudian
klasifikasikan zat-zat tersebut termasuk bersifat asam atau basa!
8