Page 25 - E-MODUL LAJU REAKSI
P. 25
Teori Tumbukan
Teori Tumbukan
Reaksi kimia merupakan proses perubahan suatu
zat menjadi zat lain (zat baru). Reaksi kimia
berlangsung ketika terjadi interaksi antara molekul-
molekul pereaksi atau terjadi tumbukan antara
molekul-molekul pereaksi.
Namun, tidak semua tumbukan antar molekul
pereaksi akan menghasilkan zat hasil reaksi. Hanya
tumbukan efektif yang yang akan menghasilkan zat
hasil reaksi. Keefektifan suatu tumbukan tergantung
pada posisi/orientasi molekul dan energi kinetik
yang dimilikinya.
Dalam teori tumbukan, ada dua syarat yang harus
dipenuhi agar tumbukan antara molekul-molekul dapat
menghasilkan reaksi. Pertama, molekul-molekul reaktan
harus bertumbukan dengan orientasi (arah) yang tepat
agar terbentuk kompleks teraktivasi dan dengan segera
akan menjadi molekul hasil reaksi. Sedangkan jika arah
orientasi molekul yang bertumbukan tidak tepat, maka
tidak akan terbentuk kompleks teraktivasi dan produk,
melainkan tetap menjadi molekul pereaksi.
Kedua, molekul pereaksi harus memiliki energi
minimum agar tumbukan antar molekul
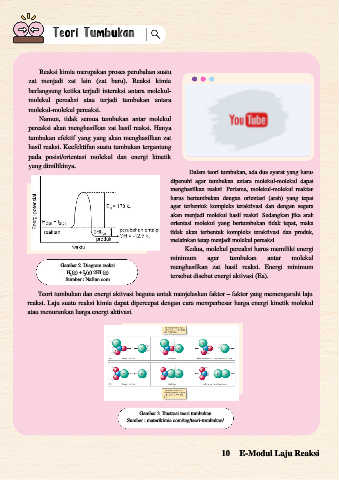
Gambar 2. Diagram reaksi menghasilkan zat hasil reaksi. Energi minimum
H (g) + I (g) 2HI (g)
2
2
Sumber : Nafiun.com tersebut disebut energi aktivasi (Ea).
Teori tumbukan dan energi aktivasi beguna untuk menjelaskan faktor – faktor yang memengaruhi laju
reaksi. Laju suatu reaksi kimia dapat dipercepat dengan cara memperbesar harga energi kinetik molekul
atau menurunkan harga energi aktivasi.
Gambar 3. Ilustrasi teori tumbukan
Sumber : materikimia.com/tag/teori-tumbukan/
10 E-Modul Laju Reaksi