Page 52 - MODUL KIMIA
P. 52
pasangan antar elektron di kulit valensi menjadi minimal.
Karena ikatan kovalen terbentuk dari pemakaian pasangan elektron secara bersama oleh
dua atom yang berikatan, perubahan sudut ikat menyebabkan perubahan posisi relatif pasangan
elektron di sekitar atom pusat. Bila dua elektron saling mendekat, maka akan terjadi gaya tolak
menolak di antara kedua elektron tersebut. Konsekuensinya, dalam terminologi energi, kedua elektron
akan saling menjauhi. Teori VSEPR, memaparkan prosedur untuk memprediksi bentuk molekul
dengan energi potensial terendah sebagai akibat adanya tolakan pasangan elektron. Teori VSEPR
mengasumsikan bahwa setiap atom akan mencapai bentuk dengan tolakan antar elektron yang dalam
kulit terluar seminimal mungkin.
Penggambaran bentuk molekul dengan bantuan VSEPR didasari oleh penggambaran
struktur Lewis sebagai model 2 dimensi. Dalam teori VSEPR atom pusat akan menempatkan secara
relatif grup (bisa berupa atom atau pasangan elektron) pada posisi tertentu. Prinsip dasarnya: masing-
masing grup elektron valensi ditempatkan sejauh mungkin satu sama lain untuk meminimalkan gaya
tolakan. Notasi yang dipakai: A = Atom Pusat, B = Pasangan Elektron Ikatan (PEI) dan E =
Pasangan Elektron Bebas (PEB) pada atom pusat.
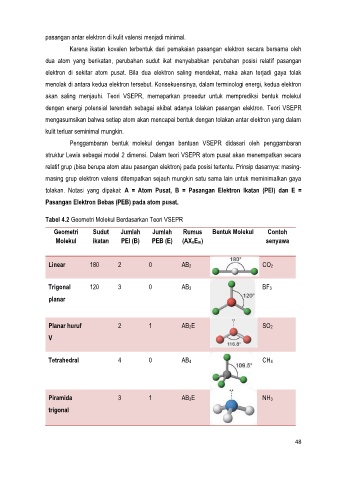
Tabel 4.2 Geometri Molekul Berdasarkan Teori VSEPR
Geometri Sudut Jumlah Jumlah Rumus Bentuk Molekul Contoh
Molekul ikatan PEI (B) PEB (E) (AXnEm) senyawa
Linear 180 2 0 AB2 CO2
Trigonal 120 3 0 AB3 BF3
planar
Planar huruf 2 1 AB2E SO2
V
Tetrahedral 4 0 AB4 CH4
Piramida 3 1 AB3E NH3
trigonal
48