Page 21 - E-MODUL LAJU REAKSI
P. 21
Secara matematika, laju reaksi dapat dijelaskan sebagai berikut. Misalkan, diketahui
persamaan stoikiometri :
mA+ nB → pC + qD
Berdasarkan persamaan tersebut, laju reaksi diartikan sebagai berkurangnya pereaksi
A atau B dan bertambahnya produk C atau D tiap satuan waktu. Dalam hal ini berlaku
bahwa perbandingan laju reaksi dari masing-masing zat yang terlibat dalam reaksi sama
dengan perbandingan koefisien reaksi dari masing-masing zat tersebut.
vA : vB : vC : vD = m : n : p : q
A
Koefisien reaksi sangat memengaruhi laju reaksi,
dapat dituliskan sebagai berikut :
Laju pengurangan x laju berkurangnya A
Laju pengurangan x laju berkurangnya A
B Laju pengurangan x laju berkurangnya A
Untuk membedakan pengurangan dan
pertambahan laju reaksi, laju pengurangan bertanda
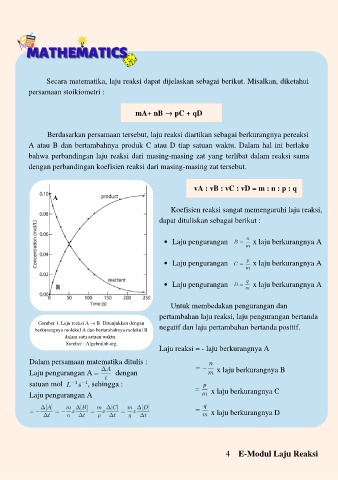
Gambar 1. Laju reaksi A → B. Ditunjukkan dengan
berkurangnya molekul A dan bertambahnya molekul B negatif dan laju pertambahan bertanda positif.
dalam satu sa tuan waktu.
Sumber : Algebralab.org
Laju reaksi = - laju berkurangnya A
Dalam persamaan matematika ditulis :
Laju pengurangan A dengan x laju berkurangnya B
satuan mol , sehingga :
Laju pengurangan A x laju berkurangnya C
x laju berkurangnya D
4 E-Modul Laju Reaksi