Page 35 - E-MODUL STEM-PJBL UNSUR GOLONGAN HALOGEN
P. 35
interaksi antara orbital p dalam
atom halogen yang satu
dengan orbital d dalam atom
halogen yang lain, sehingga
antara atom-atom halogen itu
terdapat ikatan π selain ikatan
σ. Pada F2 hal tersebut tidak
dimungkinkan, karena F tidak
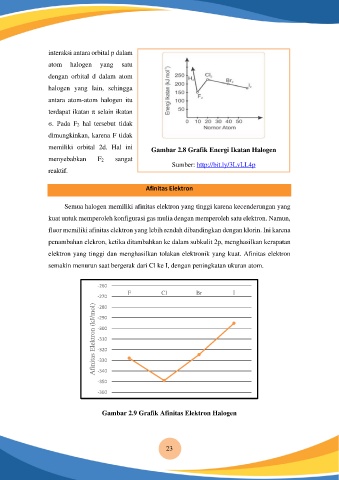
memiliki orbital 2d. Hal ini Gambar 2.8 Grafik Energi Ikatan Halogen
menyebabkan F2 sangat
Sumber: http://bit.ly/3LvLL4p
reaktif.
Afinitas Elektron
Semua halogen memiliki afinitas elektron yang tinggi karena kecenderungan yang
kuat untuk memperoleh konfigurasi gas mulia dengan memperoleh satu elektron. Namun,
fluor memiliki afinitas elektron yang lebih rendah dibandingkan dengan klorin. Ini karena
penambahan elekron, ketika ditambahkan ke dalam subkulit 2p, menghasilkan kerapatan
elektron yang tinggi dan menghasilkan tolakan elektronik yang kuat. Afinitas elektron
semakin menurun saat bergerak dari Cl ke I, dengan peningkatan ukuran atom.
-260
F Cl Br I
-270
Afinitas Elektron (kJ/mol) -300
-280
-290
-310
-320
-330
-340
-350
-360
Gambar 2.9 Grafik Afinitas Elektron Halogen
23