Page 12 - Salinan dari e-modul Elektrolisis (Binro Naibaho)
P. 12
2. Reaksi reduksi terjadi di katode dan reaksi oksidasi terjadi di anode.
3. Katode merupakan kutub negatif, sedangkan anode merupakan
kutub positif.
4. Perubahan energi terjadi dari energi listrik menjadi energi kimia.
5. Reaksi terjadi secara tidak spontan dan berlangsung dengan
bantuan energi listrik dari luar berupa batu baterai atau aki.
Sumber : Cambridge International
-
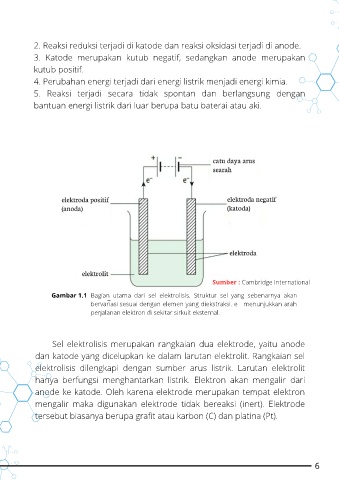
Gambar 1.1 Bagian utama dari sel elektrolisis. Struktur sel yang sebenarnya akan
bervariasi sesuai dengan elemen yang diekstraksi. e menunjukkan arah
perjalanan elektron di sekitar sirkuit eksternal.
Sel elektrolisis merupakan rangkaian dua elektrode, yaitu anode
dan katode yang dicelupkan ke dalam larutan elektrolit. Rangkaian sel
elektrolisis dilengkapi dengan sumber arus listrik. Larutan elektrolit
hanya berfungsi menghantarkan listrik. Elektron akan mengalir dari
anode ke katode. Oleh karena elektrode merupakan tempat elektron
mengalir maka digunakan elektrode tidak bereaksi (inert). Elektrode
tersebut biasanya berupa grafit atau karbon (C) dan platina (Pt).
6