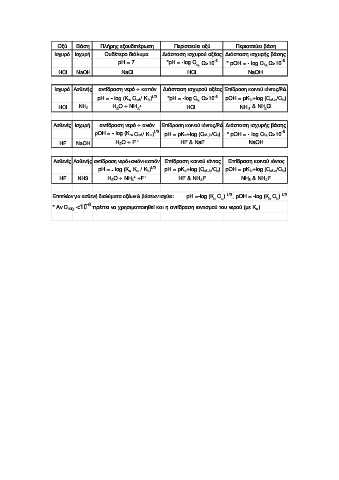
Page 27 - g lyk
P. 27
Οξύ Βάση Πλήρης εξουδετέρωση Περισσεύει οξύ Περισσεύει βάση
Ισχυρό Ισχυρή Ουδέτερο διάλυµα ∆ιάσταση ισχυρού οξέος ∆ιάσταση ισχυρής βάσης
pH = 7 *pH = -log C a, C>10 -6 * pOH = - log C b, C>10 -6
HCl NaOH NaCl HCl NaOH
Ισχυρό Ασθενής αντίδραση νερό + κατιόν ∆ιάσταση ισχυρού οξέος Επίδραση κοινού ιόντος/Ρ∆
pH = - log (K C / K ) 1/2 *pH = -log C C>10 -6 pOH = pK +log (C , /C )
w
b
a,
b
αλ a
αλ
b
+
HCl ΝΗ 3 H 2 O + NH 4 ΗCl NH 3 & NH 4 Cl
Ασθενές Ισχυρή αντίδραση νερό + ανιόν Επίδραση κοινού ιόντος/Ρ∆ ∆ιάσταση ισχυρής βάσης
pΟH = - log (K C / K ) 1/2 pH = pK +log (C , /C ) * pOH = - log C C>10 -6
w αλ α α αλ b a b,
ΗF NaOH H O + F - HF & NaF NaOH
2
Ασθενές Ασθενής αντίδραση νερό+ανιόν+κατιόν Επίδραση κοινού ιόντος Επίδραση κοινού ιόντος
pH = - log (K w Κ a / K b ) 1/2 pH = pK α +log (C αλ , b /C a ) pOH = pK b +log (C αλ , a /C b )
+
ΗF ΝΗ3 H 2 O + NH 4 +F - HF & NH 4 F NH 3 & NH 4 F
Επιπλέον για ασθενή διαλύµατα οξέων & βάσεων ισχύει: pH =-log (K C ) 1/2 , pOH = -log (K C ) 1/2
a
a
b
b
-6
* Αν C <10 πρέπει να χρησιµοποιηθεί και η αντίδραση ιοντισµού του νερού.(µε K w )
ισχ