Page 118 - LAJU REAKSI: STEM-PjBL BERABASIS AR TERINTEGRASI GREEN CHEMISTRY_Neat
P. 118
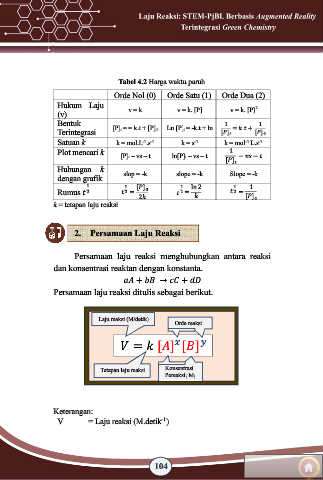
Tabel 4.2 Harga waktu paruh
Orde Nol (0) Orde Satu (1) Orde Dua (2)
Hukum Laju v = k v = k. [P] v = k. [P]
2
(v)
Bentuk [P]t = = k.t + [P]0 Ln [P]t = -k.t + ln 1 1
Terintegrasi [ ] = . + [ ] 0
Satuan k k = mol.L .s k = s -1 k = mol .L.s -1
-1 -1
-1
Plot mencari k [P]t – vs – t ln[P]t – vs – t 1 − −
[ ]
Hubungan k
dengan grafik slop = -k slope = -k Slope = -k
1 1 1 ln 2 1 1
Rumus 2 2 = [ ] 0 2 = 2 =
2 [ ] 0
k = tetapan laju reaksi
2. Persamaan Laju Reaksi
Persamaan laju reaksi menghubungkan antara reaksi
dan konsentrasi reaktan dengan konstanta.
+ → +
Persamaan laju reaksi ditulis sebagai berikut.
Laju reaksi (M/detik)
Orde reaksi
= [ ] [ ]
Tetapan laju reaksi Konsentrasi
Pereaksi (M)
Keterangan:
V = Laju reaksi (M.detik )
-1
104