Page 29 - MODUL REDOKS BERBASIS KEARIN LOKAL
P. 29
4. Bilangan Oksidasi dan Reaksi Redoks
Bilangan oksidasi dapat digunakan untuk menentukan reaksi oksidasi dan
reduksi dengan cara yang paling komprehensif. Reaksi oksidasi merupakan
reaksi yang disertai dengan kenaikan bilangan oksidasi, dan reaksi reduksi
adalah reaksi yang disertai dengan penurunan bilangan oksidasi.
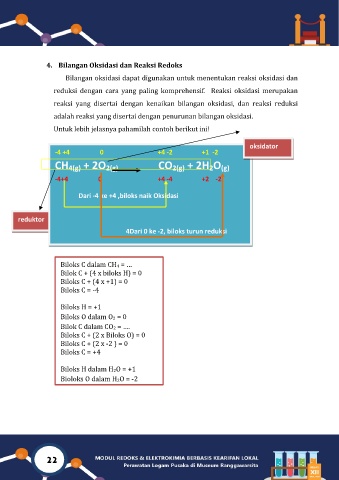
Untuk lebih jelasnya pahamilah contoh berikut ini!
oksidator
-4 +4 0 +4 -2 +1 -2
CH 4(g) + 2O 2(g) CO 2(g) + 2H O
2
(g)
-4+4 0 +4 -4 +2 -2
Dari -4 ke +4 ,biloks naik Oksidasi
reduktor
4Dari 0 ke -2, biloks turun reduksi
Biloks C dalam CH4 = …
Bilok C + (4 x biloks H) = 0
Biloks C + (4 x +1) = 0
Biloks C = -4
Biloks H = +1
Biloks O dalam O2 = 0
Bilok C dalam CO2 = ….
Biloks C + (2 x Biloks O) = 0
Biloks C + (2 x -2 ) = 0
Biloks C = +4
Biloks H dalam H2O = +1
Bioloks O dalam H2O = -2
22