Page 39 - cinetique FF_Neat
P. 39
Contrôle 16
Oxydation des ions I par S2O
-
−
2
8
-
−
2
Les ions peroxodisulfate S O oxydent les ions I . cette réaction est représentée par
l’équation bilan suivante 2 8
-
−
−
2
2
S 2 O + 2 I →2SO + I 2
4
8
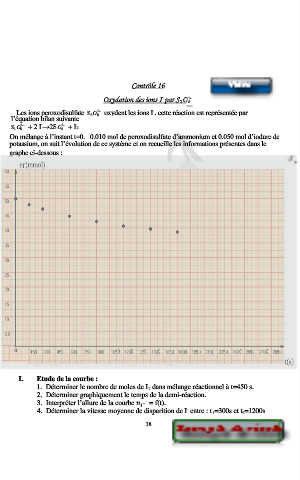
On mélange à l’instant t=0. 0.010 mol de peroxodisulfate d’ammonium et 0.050 mol d’iodure de
potassium, on suit l’évolution de ce système et on recueille les informations présentes dans le
graphe ci-dessous :
0
I. Etude de la courbe :
1. Déterminer le nombre de moles de I 2 dans mélange réactionnel à t=450 s.
2. Déterminer graphiquement le temps de la demi-réaction.
-
3. Interpréter l’allure de la courbe − = f(t).
-
4. Déterminer la vitesse moyenne de disparition de I entre : t 1=300s et t 2=1200s
38