Page 12 - E-Modul Fisling Berbasis STEM_Neat
P. 12
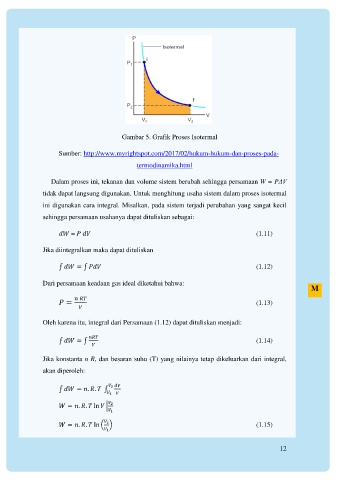
Gambar 5. Grafik Proses Isotermal
Sumber: http://www.myrightspot.com/2017/02/hukum-hukum-dan-proses-pada-
termodinamika.html
Dalam proses ini, tekanan dan volume sistem berubah sehingga persamaan W = PΔV
tidak dapat langsung digunakan. Untuk menghitung usaha sistem dalam proses isotermal
ini digunakan cara integral. Misalkan, pada sistem terjadi perubahan yang sangat kecil
sehingga persamaan usahanya dapat dituliskan sebagai:
= P (1.11)
Jika diintegralkan maka dapat dituliskan
∫ = ∫ (1.12)
Dari persamaan keadaan gas ideal diketahui bahwa:
M
= (1.13)
Oleh karena itu, integral dari Persamaan (1.12) dapat dituliskan menjadi:
∫ = ∫ (1.14)
Jika konstanta n R, dan besaran suhu (T) yang nilainya tetap dikeluarkan dari integral,
akan diperoleh:
∫ = . . ∫ 2
1
2
= . . ln |
1
= . . ln ( ) (1.15)
2
1
12