Page 44 - FORMULARIO FISICA
P. 44
Formulario de FÍSICA Formulario de FÍSICA
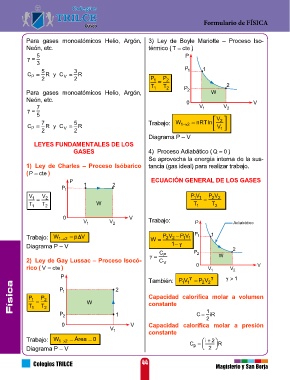
Para gases monoatómicos Helio, Argón, 3) Ley de Boyle Mariotte – Proceso Iso- Segunda Ley de la Termodinámica Proceso 1 – 2 : Expansión isotérmica
Neón, etc. térmico ( T cte ) “Es imposible construir una máquina térmi- Proceso 2 – 3 : Expansión adiabática
5 P ca capaz de convertir todo el calor que se
3 le entrega en trabajo” Proceso 3 – 4 : Compresión isotérmica
5 3 P 1 1
C P 2 R y C V 2 R P P Proceso 4 – 1 : Compresión adiabática
T 1 1 T 2 2 P 2 Equivalente mecánico del calor
Para gases monoatómicos Helio, Argón, 2 W 1 J 0,24 cal 1 cal 4,187 J Eficiencia máxima para el ciclo de Carnot:
Neón, etc. 0 V T
7 V 1 V 2 Máquina Térmica (M.T.) n 1 T F
5 V Es aquel dispositivo mecánico que trans- C
7 5 Trabajo: W nRTln 2 forma el calor que se le transfiere en traba- T : Temperatura del foco frío
F
C P 2 R y C V 2 R 12 V 1 jo. T : Temperatura del foco caliente
Diagrama P – V C
LEYES FUNDAMENTALES DE LOS Eficiencia ( ) Relación de Kelvin:
GASES 4) Proceso Adiabático ( Q 0 ) T
Se aprovecha la energía interna de la sus- Q 1 T F Q F
1) Ley de Charles – Proceso Isóbarico tancia (gas ideal) para realizar trabajo. 1 T C Q C
(P cte )
P ECUACIÓN GENERAL DE LOS GASES M.T. W Entropía
P 1 1 2 Q
V 1 V 2 PV P V 2 Es la medida de la no disponibilidad de
2 2
11
T 1 T 2 W T 1 T 2 T 2 energía en un sistema termodinámico. En
un proceso irreversible, tal como la pérdida
Q W 1 Q 2 Q 2 de calor que tiene lugar en una máquina de
0 V 1 V 2 V Trabajo: P Adiabático Q Q 1 Q vapor o de combustión interna, la entropía
1 T Q T 1 aumenta.
Trabajo: W 12 p V W P V PV P 1 1 1 T 2 Q 2 T 2 1
2 2
11
Diagrama P – V 1 2 1 1 1 En un proceso reversible, la entropía del
sistema aislado decrece, si se le comunica
C P P 2 W Ciclo de Carnot
2) Ley de Gay Lussac – Proceso Isocó- C V energía de una fuente externa. El aumento
o disminución de la entropía está dado por
rico ( V cte ) 0 V 1 V 2 V Es el ciclo de máxima eficiencia, constituido la relación entre el calor y la temperatura
P También: P V P V 1 por dos procesos isotérmicos y dos proce- (absoluta).
sos adiabáticos.
2 2
11
Física P T 1 1 P T 2 2 P 1 W 2 Capacidad calorífica molar a volumen p 1 Entalpía (H) S Q Física
T
constante
1
iR
C
2
P 0 2 1 V Capacidad calorífica molar a presión 2 Es la suma de la energía interna de la ma-
V 1 constante 4 3 teria y el producto de su volumen multipli-
Trabajo: W 12 Área 0 C i2 R V cado por la presión PV
Diagrama P – V p 2 H U
Colegios TRILCE 44 Magisterio y San Borja Colegios TRILCE 45 Magisterio y San Borja