Page 16 - E-Modul Interaktif Kimia Materi Bentuk Molekul
P. 16
KIMIA
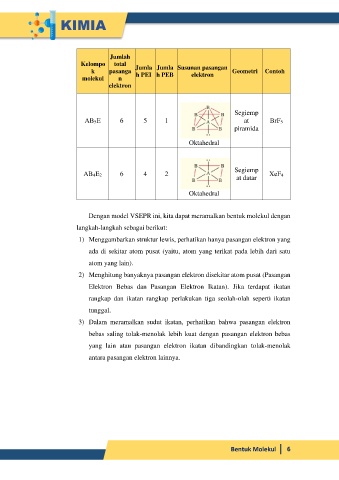
Jumlah
Kelompo total Jumla Jumla Susunan pasangan
k pasanga Geometri Contoh
molekul n h PEI h PEB elektron
elektron
Segiemp
AB5E 6 5 1 at BrF5
piramida
Oktahedral
Segiemp
AB4E2 6 4 2 XeF4
at datar
Oktahedral
Dengan model VSEPR ini, kita dapat meramalkan bentuk molekul dengan
langkah-langkah sebagai berikut:
1) Menggambarkan struktur lewis, perhatikan hanya pasangan elektron yang
ada di sekitar atom pusat (yaitu, atom yang terikat pada lebih dari satu
atom yang lain).
2) Menghitung banyaknya pasangan elektron disekitar atom pusat (Pasangan
Elektron Bebas dan Pasangan Elektron Ikatan). Jika terdapat ikatan
rangkap dan ikatan rangkap perlakukan tiga seolah-olah seperti ikatan
tunggal.
3) Dalam meramalkan sudut ikatan, perhatikan bahwa pasangan elektron
bebas saling tolak-menolak lebih kuat dengan pasangan elektron bebas
yang lain atau pasangan elektron ikatan dibandingkan tolak-menolak
antara pasangan elektron lainnya.
Bentuk Molekul 6