Page 43 - E-Modul Larutan Penyangga Kelas XI
P. 43
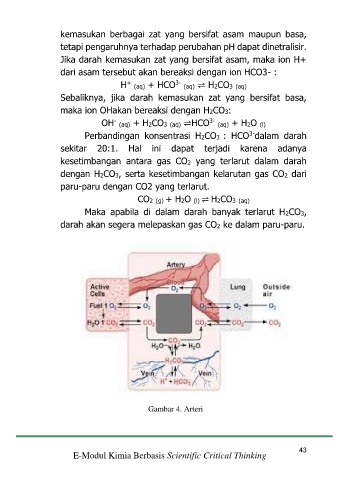
kemasukan berbagai zat yang bersifat asam maupun basa,
tetapi pengaruhnya terhadap perubahan pH dapat dinetralisir.
Jika darah kemasukan zat yang bersifat asam, maka ion H+
dari asam tersebut akan bereaksi dengan ion HCO3- :
H (aq) + HCO (aq) ⇌ H2CO3 (aq)
+
3-
Sebaliknya, jika darah kemasukan zat yang bersifat basa,
maka ion OHakan bereaksi dengan H2CO3:
OH (aq) + H2CO3 (aq) ⇌HCO (aq) + H2O (l)
3-
-
Perbandingan konsentrasi H2CO3 : HCO dalam darah
3-
sekitar 20:1. Hal ini dapat terjadi karena adanya
kesetimbangan antara gas CO2 yang terlarut dalam darah
dengan H2CO3, serta kesetimbangan kelarutan gas CO2 dari
paru-paru dengan CO2 yang terlarut.
CO2 (g) + H2O (l) ⇌ H2CO3 (aq)
Maka apabila di dalam darah banyak terlarut H2CO3,
darah akan segera melepaskan gas CO2 ke dalam paru-paru.
Gambar 4. Arteri
43
E-Modul Kimia Berbasis Scientific Critical Thinking