Page 29 - E-BOOK STOIKIOMETRI
P. 29
E. Rumus Kimia
Rumus kimia dapat dibedakan menjadi rumus empiris dan rumus molekul. Bagaimana
membedakan rumus empiris dan rumus molekul? Simaklah uraian berikut.
1. Rumus Empiris (RE)
Rumus empiris adalah rumus yang menunjukkan perbandingan paling sederhana
jumlah atom-atom dalam satu mol molekul senyawa. Telah diketahui bahwa 1
mol atom unsur mengandung 6,02 10 atom. Dengan demikian, dalam 1 mol
3
molekul senyawa, perbandingan jumlah atom perbandingan jurnlah mol atom.
Jadi, rumus empiris menyatakan perbandingan mol paling sederhana atom-atom
unsur dalam suatu sampel senyawa. Jumlah atom tidak mungkin bernilai pecahan
atau desimal. Oleh karena itu, perbandingan jumlah mol harus dinyatakan dengan
bilangan bulat paling sederhana (1, 2, 3, …). Nilai perbandingan ini dapat
diperoleh dengan membagi jumlah mol setiap atom dengan mol atom yang
jumlahnya paling kecil.
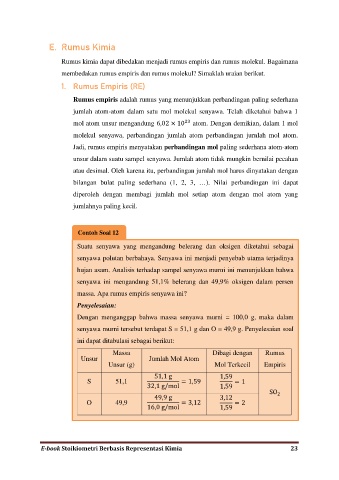
Contoh Soal 12
Suatu senyawa yang mengandung belerang dan oksigen diketahui sebagai
senyawa polutan berbahaya. Senyawa ini menjadi penyebab utama terjadinya
hujan asam. Analisis terhadap sampel senyawa murni ini menunjukkan bahwa
senyawa ini mengandung 51,1% belerang dan 49,9% oksigen dalam persen
massa. Apa rumus empiris senyawa ini?
Penyelesaian:
Dengan menganggap bahwa massa senyawa murni = 100,0 g, maka dalam
senyawa murni tersebut terdapat S = 51,1 g dan O = 49,9 g. Penyelesaian soal
ini dapat ditabulasi sebagai berikut:
Massa Dibagi dengan Rumus
Unsur Jumlah Mol Atom
Unsur (g) Mol Terkecil Empiris
51,1 g 1,59
S 51,1 32,1 g/mo = 1,59 1,59 = 1
49,9 g 3,12 SO
O 49,9 = 3,12 = 2
16,0 g/mo 1,59
E-book Stoikiometri Berbasis Representasi Kimia 23