Page 32 - Larutan Penyangga
P. 32
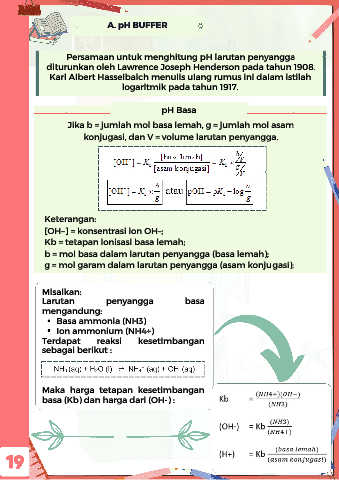
A. pH BUFFER
Persamaan untuk menghitung pH larutan penyangga
diturunkan oleh Lawrence Joseph Henderson pada tahun 1908.
Karl Albert Hasselbalch menulis ulang rumus ini dalam istilah
logaritmik pada tahun 1917.
pH Basa
Jika b = jumlah mol basa lemah, g = jumlah mol asam
konjugasi, dan V = volume larutan penyangga.
Keterangan:
[OH–] = konsentrasi ion OH–;
Kb = tetapan ionisasi basa lemah;
b = mol basa dalam larutan penyangga (basa lemah);
g = mol garam dalam larutan penyangga (asam konjugasi);
Misalkan:
Larutan penyangga basa
mengandung:
Basa ammonia (NH3)
Ion ammonium (NH4+)
Terdapat reaksi kesetimbangan
sebagai berikut :
Maka harga tetapan kesetimbangan
basa (Kb) dan harga dari (OH-) :