Page 45 - Emodul Ayu Ningsih OK 23 juni 2025
P. 45
Pengamatan warna larutan pada titrasi asam basa
menggunakan indikator asam basa akan selalu mengandung
risiko kesalahan karena keterbatasan mata dalam proses
pengamatan. Untuk mengatasi hal tersebut, maka lebih baik
digunakan indikator dengan trayek pH yang mendekati titik
ekivalennya.
Titrasi asam basa pada dasarnya adalah reaksi penetralan.
Persamaan ion bersih reaksi penetralan tersebut adalah
H (aq) + OH (aq) → H2O(l)
+
–
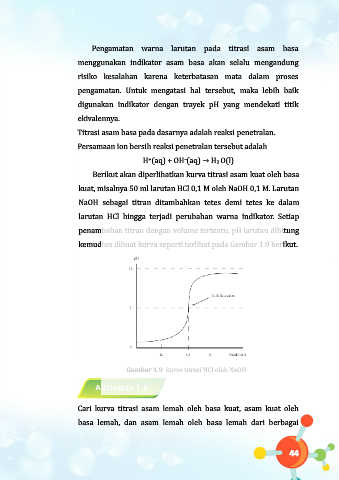
Berikut akan diperlihatkan kurva titrasi asam kuat oleh basa
kuat, misalnya 50 ml larutan HCl 0,1 M oleh NaOH 0,1 M. Larutan
NaOH sebagai titran ditambahkan tetes demi tetes ke dalam
larutan HCl hingga terjadi perubahan warna indikator. Setiap
penambahan titran dengan volume tertentu, pH larutan dihitung
kemudian dibuat kurva seperti terlibat pada Gambar 1.9 berikut.
Gambar 1.9 kurva titrasi HCl oleh NaOH
Cari kurva titrasi asam lemah oleh basa kuat, asam kuat oleh
basa lemah, dan asam lemah oleh basa lemah dari berbagai
44