Page 14 - E-Modul Larutan Asam dan Basa Berbasis Kontekstual
P. 14
2. Basa
Menurut Arrhenius, “basa” didefinisikan sebagai suatu senyawa yang apabila
dilarutkan dalam air dapat menghasilkan ion hidroksida (OH ). Jadi, pembawa sifat basa
-
-
adalah ion OH . Basa Arrhenius merupakan hidroksida logam yang dapat dirumuskan
-
sebagai M(OH)x, yang apabila dilarutkan dalam air akan membebaskan (OH ) sesuai
dengan persamaan reaksi berikut:
Mg(OH)2(aq) → Mg 2+ (aq) + 2OH (aq)
-
Jumlah ion OH yang dapat dilepaskan oleh tiap molekul basa disebut valensi basa.
-
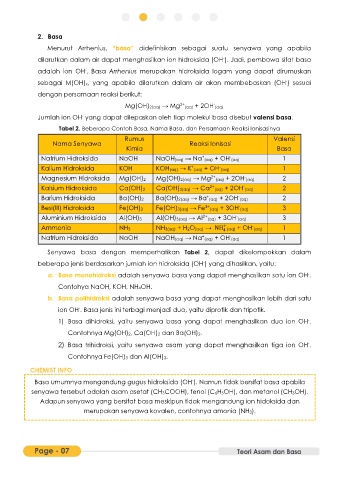
Tabel 2. Beberapa Contoh Basa, Nama Basa, dan Persamaan Reaksi Ionisasinya
Rumus Valensi
Nama Senyawa Reaksi Ionisasi
Kimia Basa
+
-
Natrium Hidroksida NaOH NaOH(aq) → Na (aq) + OH (aq) 1
-
Kalium Hidroksida KOH KOH(aq) → K (aq) + OH (aq) 1
+
-
Magnesium Hidroksida Mg(OH)2 Mg(OH)2(aq) → Mg 2+ (aq) + 2OH (aq) 2
Kalsium Hidroksida Ca(OH)2 Ca(OH)2(aq) → Ca 2+ (aq) + 2OH (aq) 2
-
Barium Hidroksida Ba(OH)2 Ba(OH)2(aq) → Ba (aq) + 2OH (aq) 2
+
-
-
Besi(III) Hidroksida Fe(OH)3 Fe(OH)3(aq) → Fe 3+ (aq) + 3OH (aq) 3
-
Aluminium Hidroksida Al(OH)3 Al(OH)3(aq) → Al 2+ (aq) + 3OH (aq) 3
Ammonia NH3 NH3(aq) + H2O(aq) → NH (aq) + OH (aq) 1
-
+
4
Natrium Hidroksida NaOH NaOH(aq) → Na (aq) + OH (aq) 1
-
+
Senyawa basa dengan memperhatikan Tabel 2, dapat dikelompokkan dalam
beberapa jenis berdasarkan jumlah ion hidroksida (OH ) yang dihasilkan, yaitu:
-
-
a. Basa monohidroksi adalah senyawa basa yang dapat menghasilkan satu ion OH .
Contohya NaOH, KOH, NH4OH.
b. Basa polihidroksi adalah senyawa basa yang dapat menghasilkan lebih dari satu
ion OH . Basa jenis ini terbagi menjadi dua, yaitu diprotik dan tripotik.
-
-
1) Basa dihidroksi, yaitu senyawa basa yang dapat menghasilkan dua ion OH .
Contohnya Mg(OH)2, Ca(OH)2 dan Ba(OH)2.
2) Basa trihidroksi, yaitu senyawa asam yang dapat menghasilkan tiga ion OH .
-
Contohnya Fe(OH)3 dan Al(OH)3.
CHEMIST INFO
-
Basa umumnya mengandung gugus hidroksida (OH ). Namun tidak bersifat basa apabila
senyawa tersebut adalah asam asetat (CH3COOH), fenol (C6H5OH), dan metanol (CH3OH).
Adapun senyawa yang bersifat basa meskipun tidak mengandung ion hidoksida dan
merupakan senyawa kovalen, contohnya amonia (NH3).