Page 7 - MODUL
P. 7
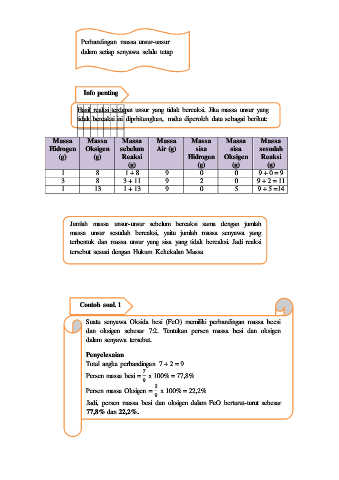
Perbandingan massa unsur-unsur
dalam setiap senyawa selalu tetap
Info penting
Hasil reaksi terdapat unsur yang tidak bereaksi. Jika massa unsur yang
tidak bereaksi ini diprhitungkan, maka diperoleh data sebagai berikut:
Massa Massa Massa Massa Massa Massa Massa
Hidrogen Oksigen sebelum Air (g) sisa sisa sesudah
(g) (g) Reaksi Hidrogen Oksigen Reaksi
(g) (g) (g) (g)
1 8 1 + 8 9 0 0 9 + 0 = 9
3 8 3 + 11 9 2 0 9 + 2 = 11
1 13 1 + 13 9 0 5 9 + 5 =14
Jumlah massa unsur-unsur sebelum bereaksi sama dengan jumlah
massa unsur sesudah bereaksi, yaitu jumlah massa senyawa yang
terbentuk dan massa unsur yang sisa yang tidak bereaksi. Jadi reaksi
tersebut sesuai dengan Hukum Kekekalan Massa
Contoh soal. 1
Suatu senyawa Oksida besi (FeO) memiliki perbandingan massa beesi
dan oksigen sebesar 7:2. Tentukan persen massa besi dan oksigen
dalam senyawa tersebut.
Penyelesaian
Total angka perbandingan 7 + 2 = 9
7
Persen massa besi = x 100% = 77,8%
9
2
Persen massa Oksigen = x 100% = 22,2%
9
Jadi, persen massa besi dan oksigen dalam FeO berturut-turut sebesar
77,8% dan 22,2%.