Page 12 - Sifat Koligatif Larutan
P. 12
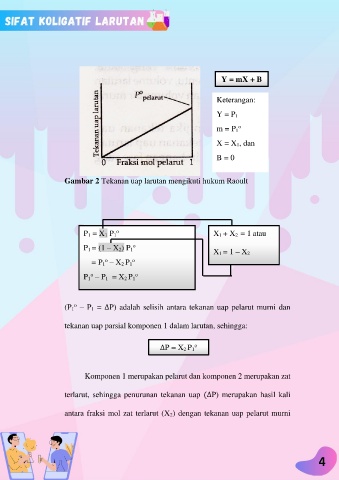
Y = mX + B
Keterangan:
Y = P 1
o
m = P 1
X = X 1, dan
B = 0
Gambar 2 Tekanan uap larutan mengikuti hukum Raoult
o X 1 + X 2 = 1 atau
P 1 = X 1 P 1
o
P 1 = (1 – X 2) P 1
X 1 = 1 – X 2
o
o
= P 1 – X 2 P 1
o o
P 1 – P 1 = X 2 P 1
(P 1 – P 1 = ∆P) adalah selisih antara tekanan uap pelarut murni dan
o
tekanan uap parsial komponen 1 dalam larutan, sehingga:
o
∆P = X 2 P 1
Komponen 1 merupakan pelarut dan komponen 2 merupakan zat
terlarut, sehingga penurunan tekanan uap (∆P) merupakan hasil kali
antara fraksi mol zat terlarut (X 2) dengan tekanan uap pelarut murni
4