Page 48 - MODUL IKATAN KIMIA BERPOLA ARGUMENTASI CER_Neat
P. 48
Ikatan Kovalen Polar dan Nonpolar
Berikut ini adalah tabel jenis ikatan kimia yang terbentuk akibat perbedaan
keelektronegatifan.
Tabel 3.1. Data perbedaan keelektronegatifan jenis ikatan kimia
Perbedaan
No. Jenis Ikatan Contoh
Elektronegativitas
Kovalen
1 0,0 s/d 0,4 H−H (0,0)
nonpolar
2 0,5 s/d 1,0 Kovalen polar H−Cl (0,9)
Kovalen sangat
3 1,0 s/d 2,0 H−F (1,9)
polar
4 ≥2 Ion NaCl (2,1)
Sumber: blogkimia.com
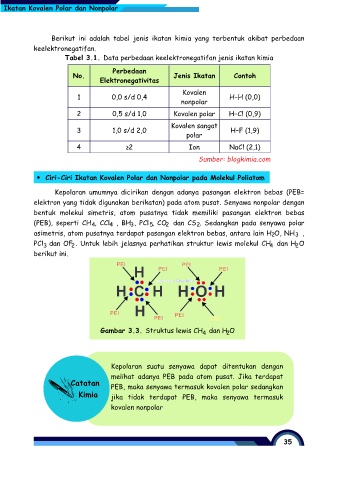
Ciri-Ciri Ikatan Kovalen Polar dan Nonpolar pada Molekul Poliatom
Kepolaran umumnya dicirikan dengan adanya pasangan elektron bebas (PEB=
elektron yang tidak digunakan berikatan) pada atom pusat. Senyawa nonpolar dengan
bentuk molekul simetris, atom pusatnya tidak memiliki pasangan elektron bebas
(PEB), seperti CH , CCl , BH , PCl , CO dan CS . Sedangkan pada senyawa polar
4
5
3
4
2
2
asimetris, atom pusatnya terdapat pasangan elektron bebas, antara lain H O, NH ,
2
3
PCl dan OF . Untuk lebih jelasnya perhatikan struktur lewis molekul CH dan H O
3
4
2
2
berikut ini.
Gambar 3.3. Struktus lewis CH dan H O
4
2
Kepolaran suatu senyawa dapat ditentukan dengan
melihat adanya PEB pada atom pusat. Jika terdapat
Catatan PEB, maka senyawa termasuk kovalen polar sedangkan
Kimia jika tidak terdapat PEB, maka senyawa termasuk
kovalen nonpolar
35