Page 229 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 229
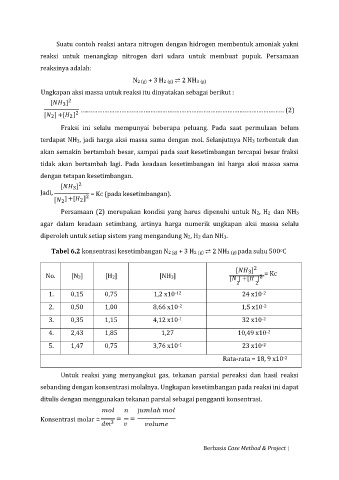
Suatu contoh reaksi antara nitrogen dengan hidrogen membentuk amoniak yakni
reaksi untuk menangkap nitrogen dari udara untuk membuat pupuk. Persamaan
reaksinya adalah:
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
Ungkapan aksi massa untuk reaksi itu dinyatakan sebagai berikut :
2
[ ]
3
[ ] +[ ] 2 …..…………………………………………………………………………………………………… (2)
2
2
Fraksi ini selalu mempunyai beberapa peluang. Pada saat permulaan belum
terdapat NH3, jadi harga aksi massa sama dengan mol. Selanjutnya NH3 terbentuk dan
akan semakin bertambah besar, sampai pada saat kesetimbangan tercapai besar fraksi
tidak akan bertambah lagi. Pada keadaan kesetimbangan ini harga aksi massa sama
dengan tetapan kesetimbangan.
2
[ ]
3
Jadi, = Kc (pada kesetimbangan).
2
[ ] +[ ] 2
2
Persamaan (2) merupakan kondisi yang harus dipenuhi untuk N2, H2 dan NH3
agar dalam keadaan setimbang, artinya harga numerik ungkapan aksi massa selalu
diperoleh untuk setiap sistem yang mengandung N2, H2 dan NH3.
o
Tabel 6.2 konsentrasi kesetimbangan N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g) pada suhu 500 C
[ ]
2
3
No. [N2] [H2] [NH3] [ ] +[ ] 2 = Kc
2 2
1. 0,15 0,75 1,2 x10 -12 24 x10
-2
2. 0,50 1,00 8,66 x10 1,5 x10
-2
-2
-2
-1
3. 0,35 1,15 4,12 x10 32 x10
4. 2,43 1,85 1,27 10,49 x10
-2
5. 1,47 0,75 3,76 x10 23 x10
-2
-1
-2
Rata-rata = 18, 9 x10
Untuk reaksi yang menyangkut gas, tekanan parsial pereaksi dan hasil reaksi
sebanding dengan konsentrasi molalnya. Ungkapan kesetimbangan pada reaksi ini dapat
ditulis dengan menggunakan tekanan parsial sebagai pengganti konsentrasi.
j
Konsentrasi molar = 3 = =
Berbasis Case Method & Project |
205