Page 368 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 368
terbentuk senyawa ionik. Kecenderungan elektronegatifitas golongan alkali dari Li ke Sc
semakin kecil.
Atom-atom logam alkali terikat satu sama lainnya dengan ikatan logam. Kekuatan
ikatan logam dipengaruhi oleh rapatnya muatan ion positif dan rapat muatan awan
elektron. Meski muatan ion positif dan muatan awan elektron unsur alkali sama,
namaun jari-jari atom bertambah dari atas ke bawah dalam satu golongan. Dengan
demikian, rapat muatan ion positif dan rapat muatan awan elektron berkurang sehingga
tarik menarik ion-ion positif dan rapat muatan awan elektron semakin lemah.
Akibatnya, kekuatan ikatan logam semakin berkurang dari Li ke Cs yang tergambar dari
titik leleh logam alkali yang semakin rendah dari Li ke Cs. Selain itu, kelunakan logam-
logam alkali juga semakin bertambah dari Li ke Cs.
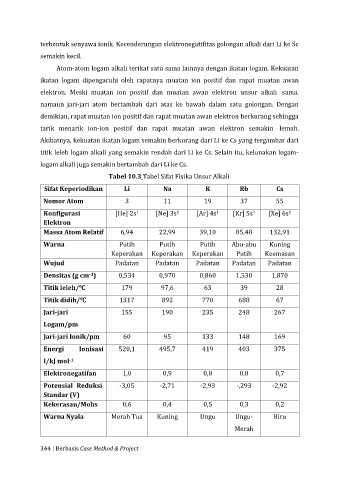
Tabel 10.3 Tabel Sifat Fisika Unsur Alkali
Sifat Keperiodikan Li Na K Rb Cs
Nomor Atom 3 11 19 37 55
1
1
1
Konfigurasi [He] 2s [Ne] 3s [Ar] 4s [Kr] 5s [Xe] 6s
1
1
Elektron
Massa Atom Relatif 6,94 22,99 39,10 85,48 132,91
Warna Putih Putih Putih Abu-abu Kuning
Keperakan Keperakan Keperakan Putih Keemasan
Wujud Padatan Padatan Padatan Padatan Padatan
-3
Densitas (g cm ) 0,534 0,970 0,860 1,530 1,870
Titik leleh/℃ 179 97,6 63 39 28
Titik didih/℃ 1317 892 770 688 67
Jari-jari 155 190 235 248 267
Logam/pm
Jari-jari Ionik/pm 60 95 133 148 169
Energi Ionisasi 520,1 495,7 419 403 375
-1
I/kJ mol
Elektronegatifan 1,0 0,9 0,8 0,8 0,7
Potensial Reduksi -3,05 -2,71 -2,93 -,293 -2,92
Standar (V)
Kekerasan/Mohs 0,6 0,4 0,5 0,3 0,2
Warna Nyala Merah Tua Kuning Ungu Ungu- Biru
Merah
344 | Berbasis Case Method & Project