Page 20 - E-MODUL ASAM BASA SENYAWA ORGANIK_ANDRA MEISANTRY ASSARI_F1062181002_PENDIDIKAN KIMIA
P. 20
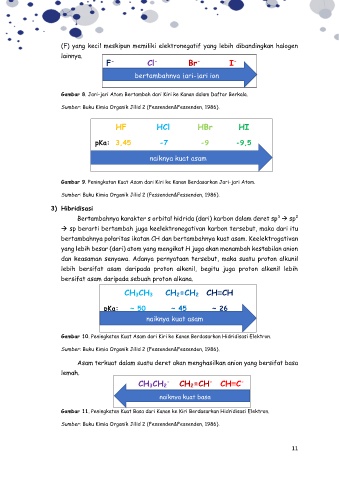
(F) yang kecil meskipun memiliki elektronegatif yang lebih dibandingkan halogen
lainnya.
-
-
F - Cl Br I -
bertambahnya jari-jari ion
Gambar 8. Jari-jari Atom Bertambah dari Kiri ke Kanan dalam Daftar Berkala.
Sumber: Buku Kimia Organik Jilid 2 (Fessenden&Fessenden, 1986).
HF HCl HBr HI
pKa: 3,45 -7 -9 -9,5
naiknya kuat asam
Gambar 9. Peningkatan Kuat Asam dari Kiri ke Kanan Berdasarkan Jari-jari Atom.
Sumber: Buku Kimia Organik Jilid 2 (Fessenden&Fessenden, 1986).
3) Hibridisasi
2
Bertambahnya karakter s orbital hidrida (dari) karbon dalam deret sp → sp
3
→ sp berarti bertambah juga keelektronegativan karbon tersebut, maka dari itu
bertambahnya polaritas ikatan CH dan bertambahnya kuat asam. Keelektrogativan
yang lebih besar (dari) atom yang mengikat H juga akan menambah kestabilan anion
dan keasaman senyawa. Adanya pernyataan tersebut, maka suatu proton alkunil
lebih bersifat asam daripada proton alkenil, begitu juga proton alkenil lebih
bersifat asam daripada sebuah proton alkana.
CH 3CH 3 CH 2=CH 2 CH≡CH
pKa: ~ 50 ~ 45 ~ 26
naiknya kuat asam
Gambar 10. Peningkatan Kuat Asam dari Kiri ke Kanan Berdasarkan Hidridisasi Elektron.
Sumber: Buku Kimia Organik Jilid 2 (Fessenden&Fessenden, 1986).
Asam terkuat dalam suatu deret akan menghasilkan anion yang bersifat basa
lemah.
-
CH 3CH 2 - CH 2=CH CH≡C -
naiknya kuat basa
Gambar 11. Peningkatan Kuat Basa dari Kanan ke Kiri Berdasarkan Hidridisasi Elektron.
Sumber: Buku Kimia Organik Jilid 2 (Fessenden&Fessenden, 1986).
11