Page 49 - (1) E-MODUL IKATAN KIMIA
P. 49
Ikatan kovalen dapat bersifat polar atau nonpolar. Sifat yang membedakan ikatan kovalen
polar dan ikatan kovalen nonpolar adalah elektronegativitas, yaitu kemampuan atom untuk
menarik elektron dalam ikatan kimia ke arahnya sendiri. Berikut ini disajikan tabel periodik
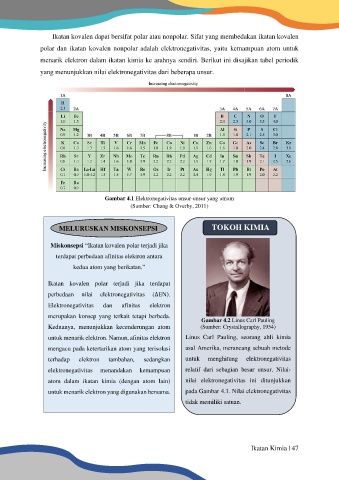
yang menunjukkan nilai elektronegativitas dari beberapa unsur.
Gambar 4.1 Elektronegativitas unsur-unsur yang umum
(Sumber: Chang & Overby, 2011)
MELURUSKAN MISKONSEPSI TOKOH KIMIA
Miskonsepsi “Ikatan kovalen polar terjadi jika
terdapat perbedaan afinitas elektron antara
kedua atom yang berikatan.”
Ikatan kovalen polar terjadi jika terdapat
perbedaan nilai elektronegativitas (∆EN).
Elektronegativitas dan afinitas elektron
merupakan konsep yang terkait tetapi berbeda.
Gambar 4.2 Linus Carl Pauling
Keduanya, menunjukkan kecenderungan atom (Sumber: Crystallography, 1954)
untuk menarik elektron. Namun, afinitas elektron Linus Carl Pauling, seorang ahli kimia
mengacu pada ketertarikan atom yang terisolasi asal Amerika, merancang sebuah metode
terhadap elektron tambahan, sedangkan untuk menghitung elektronegativitas
elektronegativitas menandakan kemampuan relatif dari sebagian besar unsur. Nilai-
atom dalam ikatan kimia (dengan atom lain) nilai elektronegativitas ini ditunjukkan
untuk menarik elektron yang digunakan bersama. pada Gambar 4.1. Nilai elektronegativitas
tidak memiliki satuan.
Ikatan Kimia | 47