Page 54 - (1) E-MODUL IKATAN KIMIA
P. 54
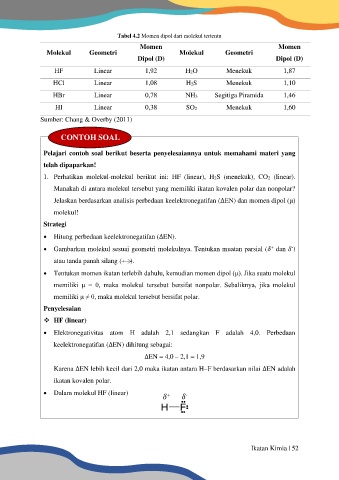
Tabel 4.2 Momen dipol dari molekul tertentu
Momen Momen
Molekul Geometri Molekul Geometri
Dipol (D) Dipol (D)
HF Linear 1,92 H2O Menekuk 1,87
HCl Linear 1,08 H2S Menekuk 1,10
HBr Linear 0,78 NH3 Segitiga Piramida 1,46
HI Linear 0,38 SO2 Menekuk 1,60
Sumber: Chang & Overby (2011)
CONTOH SOAL
Pelajari contoh soal berikut beserta penyelesaiannya untuk memahami materi yang
telah dipaparkan!
1. Perhatikan molekul-molekul berikut ini: HF (linear), H2S (menekuk), CO2 (linear).
Manakah di antara molekul tersebut yang memiliki ikatan kovalen polar dan nonpolar?
Jelaskan berdasarkan analisis perbedaan keelektronegatifan (∆EN) dan momen dipol (μ)
molekul!
Strategi
• Hitung perbedaan keelektronegatifan (∆EN).
+
-
• Gambarkan molekul sesuai geometri molekulnya. Tentukan muatan parsial ( dan )
atau tanda panah silang ( ).
• Tentukan momen ikatan terlebih dahulu, kemudian momen dipol (μ). Jika suatu molekul
memiliki μ = 0, maka molekul tersebut bersifat nonpolar. Sebaliknya, jika molekul
memiliki μ ≠ 0, maka molekul tersebut bersifat polar.
Penyelesaian
❖ HF (linear)
• Elektronegativitas atom H adalah 2,1 sedangkan F adalah 4,0. Perbedaan
keelektronegatifan (∆EN) dihitung sebagai:
∆EN = 4,0 – 2,1 = 1,9
Karena ∆EN lebih kecil dari 2,0 maka ikatan antara H–F berdasarkan nilai ∆EN adalah
ikatan kovalen polar.
• Dalam molekul HF (linear) + -
Ikatan Kimia | 52