Page 13 - E-Modul Larutan Asam dan Basa Berbasis Kontekstual (Flip PDF Professional) Versi Mobile Phone
P. 13
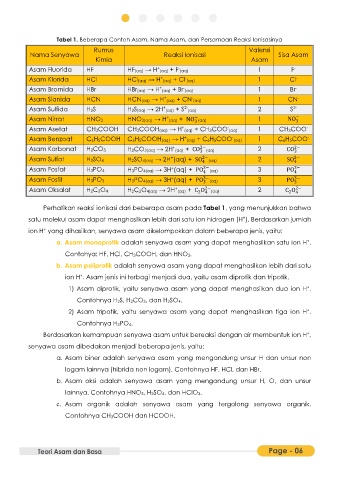
Tabel 1. Beberapa Contoh Asam, Nama Asam, dan Persamaan Reaksi Ionisasinya
Rumus Valensi
Nama Senyawa Reaksi Ionisasi Sisa Asam
Kimia Asam
-
+
Asam Fluorida HF HF(aq) → H (aq) + F (aq) 1 F -
Asam Klorida HCl HCl(aq) → H (aq) + Cl (aq) 1 Cl -
-
+
-
+
Asam Bromida HBr HBr(aq) → H (aq) + Br (aq) 1 Br -
Asam Sianida HCN HCN(aq) → H (aq) + CN (aq) 1 CN -
+
-
Asam Sulfida H2S H2S(aq) → 2H (aq) + S (aq) 2 S 2-
+
2-
Asam Nitrat HNO3 HNO3(aq) → H (aq) + NO (aq) 1 NO −
+
−
3
3
-
Asam Asetat CH3COOH CH3COOH(aq) → H (aq) + CH3COO (aq) 1 CH3COO -
+
Asam Benzoat C6H5COOH C6H5COOH(aq) → H (aq) + C6H5COO (aq) 1 C6H5COO -
+
-
Asam Karbonat H2CO3 H2CO3(aq) → 2H (aq) + CO 2− 2 CO 2−
+
3 (aq)
3
Asam Sulfat H2SO4 H2SO4(aq) → 2H (aq) + SO 2− 2 SO 2−
+
4 (aq)
4
Asam Fosfat H3PO4 H3PO4(aq) → 3H (aq) + PO 3− 3 PO 3−
+
4 (aq)
4
Asam Fosfit H3PO3 H3PO4(aq) → 3H (aq) + PO 3− 3 PO 3−
+
3 (aq)
3
Asam Oksalat H2C2O4 H2C2O4(aq) → 2H (aq) + C O 2− 2 C O 2−
+
2 4 (aq)
2 4
Perhatikan reaksi ionisasi dari beberapa asam pada Tabel 1, yang menunjukkan bahwa
satu molekul asam dapat menghasilkan lebih dari satu ion hidrogen (H ). Berdasarkan jumlah
+
ion H yang dihasilkan, senyawa asam dikelompokkan dalam beberapa jenis, yaitu:
+
+
a. Asam monoprotik adalah senyawa asam yang dapat menghasilkan satu ion H .
Contohya: HF, HCl, CH3COOH, dan HNO3.
b. Asam poliprotik adalah senyawa asam yang dapat menghasilkan lebih dari satu
+
ion H . Asam jenis ini terbagi menjadi dua, yaitu asam diprotik dan tripotik.
+
1) Asam diprotik, yaitu senyawa asam yang dapat menghasilkan dua ion H .
Contohnya H2S, H2CO3, dan H2SO4.
2) Asam tripotik, yaitu senyawa asam yang dapat menghasilkan tiga ion H .
+
Contohnya H3PO4.
Berdasarkan kemampuan senyawa asam untuk bereaksi dengan air membentuk ion H ,
+
senyawa asam dibedakan menjadi beberapa jenis, yaitu:
a. Asam biner adalah senyawa asam yang mengandung unsur H dan unsur non
logam lainnya (hibrida non logam). Contohnya HF, HCl, dan HBr.
b. Asam oksi adalah senyawa asam yang mengandung unsur H, O, dan unsur
lainnya. Contohnya HNO3, H2SO4, dan HClO3.
c. Asam organik adalah senyawa asam yang tergolong senyawa organik.
Contohnya CH3COOH dan HCOOH.