Page 16 - E-Modul Larutan Asam dan Basa Berbasis Kontekstual (Flip PDF Professional) Versi Mobile Phone
P. 16
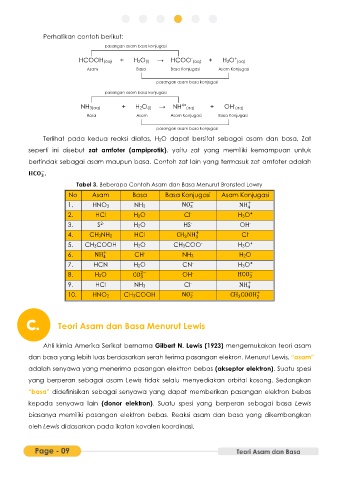
Perhatikan contoh berikut:
pasangan asam basa konjugasi
+
-
HCOOH(aq) + H2O(l) → HCOO (aq) + H3O (aq)
Asam Basa Basa Konjugasi Asam Konjugasi
pasangan asam basa konjugasi
pasangan asam basa konjugasi
-
NH3(aq) + H2O(l) → NH 4+ (aq) + OH (aq)
Basa Asam Asam Konjugasi Basa Konjugasi
pasangan asam basa konjugasi
Terlihat pada kedua reaksi diatas, H2O dapat bersifat sebagai asam dan basa. Zat
seperti ini disebut zat amfoter (ampiprotik), yaitu zat yang memiliki kemampuan untuk
bertindak sebagai asam maupun basa. Contoh zat lain yang termasuk zat amfoter adalah
.
−
Tabel 3. Beberapa Contoh Asam dan Basa Menurut Bronsted Lowry
No Asam Basa Basa Konjugasi Asam Konjugasi
1. HNO3 NH3 NO − NH +
3
4
2. HCl H2O Cl - H3O +
3. S 2- H2O HS - OH -
4. CH3NH2 HCl CH NH + Cl -
3
3
5. CH3COOH H2O CH3COO - H3O +
6. NH + CH - NH3 H2O
4
7. HCN H2O CN - H3O +
8. H2O CO 2− OH - HCO −
3 3
9. HCl NH3 Cl - NH +
4
10. HNO2 CH3COOH NO − CH COOH +
2
3
2
C. Teori Asam dan Basa Menurut Lewis
Ahli kimia Amerika Serikat bernama Gilbert N. Lewis (1923) mengemukakan teori asam
dan basa yang lebih luas berdasarkan serah terima pasangan elekron. Menurut Lewis, “asam”
adalah senyawa yang menerima pasangan elektron bebas (akseptor elektron). Suatu spesi
yang berperan sebagai asam Lewis tidak selalu menyediakan orbital kosong. Sedangkan
“basa” didefinisikan sebagai senyawa yang dapat memberikan pasangan elektron bebas
kepada senyawa lain (donor elektron). Suatu spesi yang berperan sebagai basa Lewis
biasanya memiliki pasangan elektron bebas. Reaksi asam dan basa yang dikembangkan
oleh Lewis didasarkan pada ikatan kovalen koordinasi.