Page 14 - E-Modul Larutan Asam dan Basa Berbasis Kontekstual (Flip PDF Professional) Versi Mobile Phone
P. 14
2. Basa
Menurut Arrhenius, “basa” didefinisikan sebagai suatu senyawa yang apabila dilarutkan
-
dalam air dapat menghasilkan ion hidroksida (OH ). Jadi, pembawa sifat basa adalah ion
-
OH . Basa Arrhenius merupakan hidroksida logam yang dapat dirumuskan sebagai M(OH)x,
yang apabila dilarutkan dalam air akan membebaskan (OH ) sesuai dengan persamaan
-
reaksi berikut:
-
Mg(OH)2(aq) → Mg 2+ (aq) + 2OH (aq)
Jumlah ion OH yang dapat dilepaskan oleh tiap molekul basa disebut valensi basa.
-
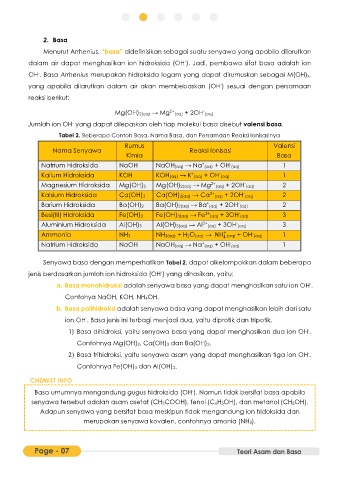
Tabel 2. Beberapa Contoh Basa, Nama Basa, dan Persamaan Reaksi Ionisasinya
Rumus Valensi
Nama Senyawa Reaksi Ionisasi
Kimia Basa
-
Natrium Hidroksida NaOH NaOH(aq) → Na (aq) + OH (aq) 1
+
-
Kalium Hidroksida KOH KOH(aq) → K (aq) + OH (aq) 1
+
-
Magnesium Hidroksida Mg(OH)2 Mg(OH)2(aq) → Mg 2+ (aq) + 2OH (aq) 2
-
Kalsium Hidroksida Ca(OH)2 Ca(OH)2(aq) → Ca 2+ (aq) + 2OH (aq) 2
Barium Hidroksida Ba(OH)2 Ba(OH)2(aq) → Ba (aq) + 2OH (aq) 2
+
-
-
Besi(III) Hidroksida Fe(OH)3 Fe(OH)3(aq) → Fe 3+ (aq) + 3OH (aq) 3
Aluminium Hidroksida Al(OH)3 Al(OH)3(aq) → Al 2+ (aq) + 3OH (aq) 3
-
Ammonia NH3 NH3(aq) + H2O(aq) → NH (aq) + OH (aq) 1
-
+
4
-
+
Natrium Hidroksida NaOH NaOH(aq) → Na (aq) + OH (aq) 1
Senyawa basa dengan memperhatikan Tabel 2, dapat dikelompokkan dalam beberapa
jenis berdasarkan jumlah ion hidroksida (OH ) yang dihasilkan, yaitu:
-
a. Basa monohidroksi adalah senyawa basa yang dapat menghasilkan satu ion OH .
-
Contohya NaOH, KOH, NH4OH.
b. Basa polihidroksi adalah senyawa basa yang dapat menghasilkan lebih dari satu
ion OH . Basa jenis ini terbagi menjadi dua, yaitu diprotik dan tripotik.
-
-
1) Basa dihidroksi, yaitu senyawa basa yang dapat menghasilkan dua ion OH .
Contohnya Mg(OH)2, Ca(OH)2 dan Ba(OH)2.
-
2) Basa trihidroksi, yaitu senyawa asam yang dapat menghasilkan tiga ion OH .
Contohnya Fe(OH)3 dan Al(OH)3.
CHEMIST INFO
Basa umumnya mengandung gugus hidroksida (OH ). Namun tidak bersifat basa apabila
-
senyawa tersebut adalah asam asetat (CH3COOH), fenol (C6H5OH), dan metanol (CH3OH).
Adapun senyawa yang bersifat basa meskipun tidak mengandung ion hidoksida dan
merupakan senyawa kovalen, contohnya amonia (NH3).