Page 22 - e book rev pakai - Salin
P. 22
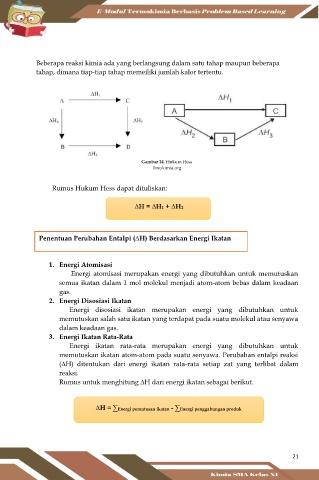
Beberapa reaksi kimia ada yang berlangsung dalam satu tahap maupun beberapa
tahap, dimana tiap-tiap tahap memeiliki jumlah kalor tertentu.
Gambar 14. Hukum Hess
ilmukimia.org
Rumus Hukum Hess dapat dituliskan:
∆H = ∆H1 + ∆H2
Penentuan Perubahan Entalpi (∆H) Berdasarkan Energi Ikatan
1. Energi Atomisasi
Energi atomisasi merupakan energi yang dibutuhkan untuk memutuskan
semua ikatan dalam 1 mol molekul menjadi atom-atom bebas dalam keadaan
gas.
2. Energi Disosiasi Ikatan
Energi disosiasi ikatan merupakan energi yang dibutuhkan untuk
memutuskan salah satu ikatan yang terdapat pada suatu molekul atau senyawa
dalam keadaan gas.
3. Energi Ikatan Rata-Rata
Energi ikatan rata-rata merupakan energi yang dibutuhkan untuk
memutuskan ikatan atom-atom pada suatu senyawa. Perubahan entalpi reaksi
(∆H) ditentukan dari energi ikatan rata-rata setiap zat yang terlibat dalam
reaksi.
Rumus untuk menghitung ∆H dari energi ikatan sebagai berikut.
∆H = ∑Energi pemutusan ikatan - ∑Energi penggabungan produk
21